

Procese in spremembe, ki se dogajajo okrog nas, lahko opišemo in jih razdelimo v 2 skupini:
fizikalne spremembe in
kemijske spremembe oziroma kemijske reakcije.
Po fizikalni spremembi se sama snov ne spremeni, lahko pa na primer spremeni svojo obliko.
Pri kemijski spremembi pa iz ene snovi nastane druga, popolnoma nova snov, ki ima drugačne kemijske in fizikalne lastnosti.
Glede na to, kaj se s snovjo tekom spremembe zgodi, lahko spremembo uvrstimo med fizikalno spremembo ali kemijsko reakcijo.
Pri fizikalni spremembi snov ohrani vse svoje kemijske lastnosti. Ne pride do nastanka novih snovi.
Med take spremembe spadajo:
sprememba oblike (npr. rezanje, mletje),
sprememba agregatnega stanja (taljenje, strjevanje, izparevanje, kondenzacija in sublimacija),
raztapljanje in podobno.
Kemijska reakcija je proces, pri katerem pride do trajne spremembe snovi. Pri kemijski reakciji nastanejo iz snovi, ki med seboj reagirajo, povsem drugačne, nove snovi.
Med kemijsko reakcijo se vezi med atomi ali molekulami prekinejo. Atomi se povežejo drugače kot prej in pride do nastanka novih vezi. Tako nastanejo nove snovi, ki imajo drugačne lastnosti, na primer barvo, temperaturo vrelišča, vonj in podobno.
Najbolj značilne spremembe snovi pri kemijski reakciji so:
sprememba barve in videza,
povečanje ali zmanjšanje mase na tehtnici - masa se poveča, če se na začetne snovi vežejo plini ali se zmanjša, če pri reakciji plin nastane,
nastanek oborine,
nastanek plina in podobno.
Pri kemijskih reakcijah se ne dogajajo samo snovne spremembe, da nastanejo nove snovi, ampak tudi energijske spremembe. Tekom kemijske reakcije ali fizikalnega procesa lahko snovi, ki reagirajo, ohladijo okolico ali pa okolico segrejejo.
Pri energiji kemijske reakcije gledamo energijo celotnega sistema, kjer poteka kemijska reakcija. Celoten sistem sestavljajo:
reaktanti,
produkti in
okolica.
Pri kemijskih reakcijah velja zakon o ohranitvi energije. Ta pravi, da se energija v sistemu ohranja tekom reakcije. Lahko pa energija prehaja iz ene oblike v drugo. Tako lahko na primer kemijska energija vezi iz reaktantov pri reakciji preide v okolico v obliki toplote ali svetlobe.
Za potek nekaterih kemijskih reakcij je potrebna energija iz okolice. Običajno potrebujemo energijo v obliki toplote. Pri nekaterih kemijskih reakcijah pa energija nastane in se sprosti v okolico.
Znotraj sistema se energija pri kemijskih reakcijah ohranja.
Ko pri kemijskih reakcijah govorimo o energiji, smo pozorni na snovi v reakciji in na okolico. Z energijo se lahko dogaja naslednje:
reakcija lahko črpa energijo iz okolice ali pa
se energija tekom reakcije sprošča v okolico.
Glede na to, ali se pri reakciji porablja energija iz okolice ali sprošča v okolico, delimo kemijske reakcije v dve skupini:
endotermne reakcije in
eksotermne reakcije.
Endotermna reakcija je takšna kemijska reakcija, ki za svoj potek potrebuje energijo iz okolice.
Da snovi reagirajo v nove produkte, jim moramo običajno dovesti toploto, brez tega reakcija ne poteče. Dovedena toplota ima tako izvor iz okolice, ne iz reaktantov. Pri reakciji snovi porabijo to toploto in s tem se okolica ohlaja.
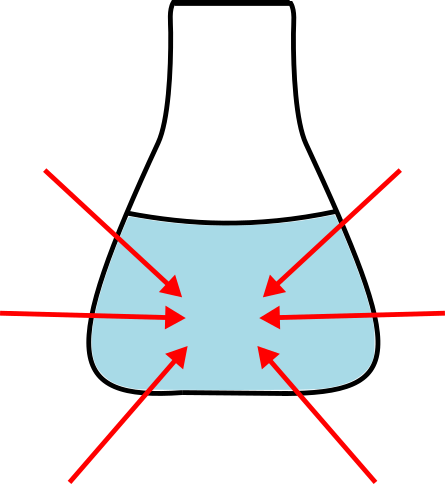
Pri endotermni reakciji reaktanti iz okolice jemljejo energijo, da kemijska reakcija lahko poteče. Z rdečimi puščicami je prikazana smer prenosa energije.
Procese in reakcije lahko predstavimo s pomočjo energijskih diagramov. Na diagramu je prikazano, kako se spreminja energija snovi v kemijski reakciji, medtem ko reaktanti reagirajo in prehajajo v produkte.
Na vodoravni osi (x-os) prikažemo potek kemijske reakcije, na navpični osi (y-os) pa energijo.
Snovi, ki vstopajo v reakcijo, imajo pred potekom reakcije določeno energijo. Da reaktanti zreagirajo v produkte, morajo iz okolice jemati energijo.
Produkti imajo zato višjo energijo, kot so jih imele začetne snovi. Energija snovi pred kemijsko reakcijo je nižja, energija nastalih snovi pa je višja. Energija produktov je višja od energije reaktantov za toliko, kolikor energije so reaktanti vzeli iz okolice, da so reagirali v produkte.
Reaktante narišemo nižje od produktov:
Ko rišemo diagram točno določene reakcije, na diagram zapišemo snovi z njihovimi imeni ali zapišemo molekulske formule.
Eksotermna reakcija oziroma eksotermen proces je kemijska reakcija, pri kateri se energija sprošča v okolico.
Snovi tekom kemijske reakcije reagirajo v produkte in pri tem oddajo energijo oziroma toploto v okolico. Z drugimi besedami to pomeni, da je energija, ki je bila uskladiščena v reaktantih, med reakcijo ušla v okolico. Temperatura okolice se zviša.
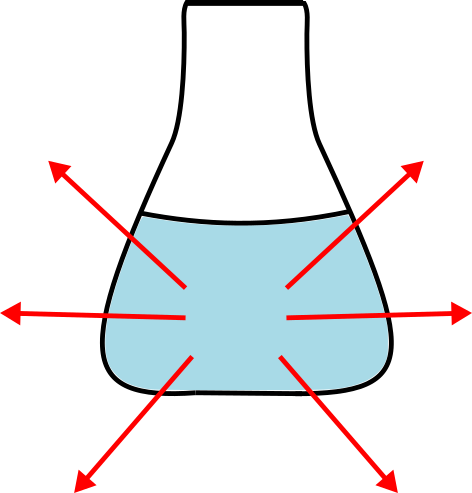
Pri eksotermni reakciji reaktanti v okolje oddajo energijo v obliki toplote. Z rdečimi puščicami je prikazana smer prenosa energije.
Poglejmo diagram eksotermne reakcije. Ko reaktanti prehajajo v produkte, se energija sprošča v okolico, zato se energija produktov zmanjša.
Produkti, ki nastanejo pri reakciji, imajo zato nižjo energijo od reaktantov. Energija produktov je toliko nižja, kolikor toplote se je med reakcijo sprostilo.
Reaktante v diagramu narišemo višje od produktov.
Ko rišemo diagram točno določene reakcije, na diagram zapišemo snovi z njihovimi imeni ali zapišemo molekulske formule.
V kemijskih reakcijah nastopajo reaktanti in produkti. Tekom kemijske reakcije se lahko reaktanti združijo v eno novo snov, lahko pa ena snov razpade na osnovne elemente. Pri kemijski reakciji se lahko neka snov združi s kisikom, ali pa kisik odda.
Glede na to, kakšna sprememba se tekom kemijske reakcije zgodi, lahko kemijsko reakcijo uvrstimo v različne kategorije.
Obstaja več vrst in delitev kemijskih reakcij. Pogledali si bomo le nekaj vrst kemijskih reakcij:
spajanje ali sinteza,
razpad ali analiza,
oksidacija,
redukcija in
obarjanje.
Katero vrsto kemijske reakcije imamo, lahko najlažje ugotovimo iz zapisa kemijske enačbe.
Spajanje ali sinteza je kemijska reakcija, pri kateri iz dveh ali več snovi nastane ena nova snov. Kemijsko reakcijo spajanja lahko zapišemo:
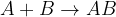
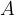 in
in 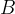 predstavljata dve različni snovi, ki se združita v eno novo snov
predstavljata dve različni snovi, ki se združita v eno novo snov 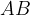 .
.
Razkroj ali analiza je kemijska reakcija, pri kateri ena snov razpade na dve ali več bolj preprostih molekul ali na elemente. Reakcija razkroja ali analize je obratna kot reakcija spajanja ali sinteze. Kemijsko reakcijo razkroja lahko zapišemo:
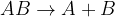
Z 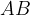 je označena poljubna snov, ki razpade na snov
je označena poljubna snov, ki razpade na snov 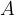 in snov
in snov 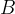 .
.
Oksdiacija in redukcija sta kemijski reakciji, pri kateri si snovi izmenjujejo elektrone. Tukaj si bomo pogledali poenostavljeno reakcijo oksidacije in reducije.
Oksidacija je kemijska reakcija, kjer neka snov reagira s kisikom 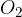 . Pri tem lahko nastanejo različni produkti. Reakcijo oksidacije prepoznamo iz zapisa reaktantov. Poleg poljubne snovi pri reakciji oksidacije nastopa kisik:
. Pri tem lahko nastanejo različni produkti. Reakcijo oksidacije prepoznamo iz zapisa reaktantov. Poleg poljubne snovi pri reakciji oksidacije nastopa kisik:
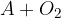
Črka 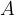 v reakciji predstavlja poljubno snov,
v reakciji predstavlja poljubno snov, 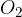 pa molekulo kisika.
pa molekulo kisika.
Redukcija je kemijska reakcija, pri kateri neka snov drugi snovi odda kisik.
Obarjanje je kemijska reakcija, pri kateri iz dveh raztopin nastane oborina. Oborina je trdna snov, ki se izloči iz raztopine.
Da gre za reakcijo oborine, prepoznamo iz zapisa agergatnega stanja. Raztopini imata tekoče agregatno stanje 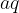 , oborina pa je trdna in ima zato agregatno stanje
, oborina pa je trdna in ima zato agregatno stanje  . Običajno je drugi produkt reakcije tudi raztopina.
. Običajno je drugi produkt reakcije tudi raztopina.
Splošno reakcijo obarjanja zapišemo:
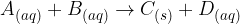
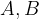 in
in 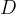 predstavljajo raztopine,
predstavljajo raztopine, 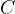 pa oborino.
pa oborino.