Osebne zbirke


Med kemijskimi reakcijami pride najprej do cepitve in nato do nastanka novih vezi, pri tem pa se porablja ali sprošča energija. V tem gradivu bomo obravnavali energetske spremembe, ki se zgodijo pri kemijskih reakcijah.
Termokemija je veda, ki proučuje energetske spremembe tekom kemijskih reakcij. Kemijske reakcije potečejo v dveh korakih:
cepitev vezi,
tvorba novih vezi.
Cepljenje vezi (v reaktantih) porablja energijo, medtem ko pa proces tvorbe novih vezi (v produktih) energijo sprošča.
Glede na celokupni izkupiček energije v teh procesih, ločimo:
Endotermne reakcije
Eksotermne reakcije
Oba procesa bomo spoznali natančneje v nadaljevanju. Najprej pa moramo spoznati merilo za take energetske spremembe, entalpijo.
Entalpija zajema vse energetske spremembe znotraj kemijske reakcije. Označimo jo s H. Entalpija je definirana kot vsota notranje energije in zmnožka tlaka in prostornine:
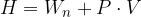
Običajno merimo spremembo energije, torej 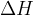 . Pri stalnem tlaku je ta sprememba enaka porabljeni oziroma sproščeni energiji.
. Pri stalnem tlaku je ta sprememba enaka porabljeni oziroma sproščeni energiji.
Standardna entalpija je merjena pri tlaku 100kPa (standardni pogoji). Standardno entalpijo označimo z  .
.
Glede na to, katero reakcijo obravnavamo, ločimo:
Tvorbeno entalpijo
Reakcijsko entalpijo
Poglejmo si natančneje, katera je tvorbena in katera reakcijska entalpija.
Standardna tvorbena entalpija je vezana na tvorbo snovi. Predstavlja energijo, ki se sprosti ali veže pri nastanku (tvorbi) enega mola spojine iz elementov v njihovih standardnih stanjih pri tlaku 100kPa. Standardno tvorbeno entalpijo označimo z:
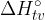
izražamo pa jo v
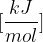
V spodnji tabeli imamo standardne tvorbene entalpije za nekaj izbranih spojin pri 25°C:
Po dogovoru velja, da je standardna tvorbena entalpija za elemente v njihovih standardnih stanjih enaka 0. Poglejmo si na primeru, kaj to pomeni.
Standardna reakcijska entalpija je vezana na celotno kemijsko reakcijo. Predstavlja toploto, ki se porabi ali sprosti pri kemijski reakciji (pri konstantnem tlaku 100kPa). Standardno reakcijsko entalpijo izračunamo kot razliko med:
vsoto standardnih tvorbenih entalpij za vsak posamezno molekulo produktov,
vsoto standardnih tvorbenih entalpij za vsako posamezno molekulo reaktantov.
Zapišimo enačbo, ki nam pove količino porabljene ali sproščene toplote v neki kemijski reakciji:
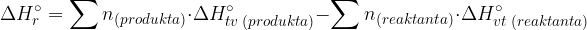
kjer je:
 standardna reakcijska entalpija z enoto
standardna reakcijska entalpija z enoto 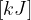 ,
,
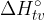 standardna tvorbena entalpija z enoto
standardna tvorbena entalpija z enoto 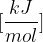 ,
,
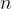 množina snovi z enoto
množina snovi z enoto 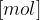 ,
,
 oznaka za matematični postopek seštevanja.
oznaka za matematični postopek seštevanja.
Glede na to ali je reakcijska entalpija večja ali nižja od nič, lahko določimo ali reakcija veže ali sprošča energijo. S pomočjo reakcijske entalpije lahko definiramo ali je reakcija endotermna ali eksotermna.
Pri endotermnih reakcijah se energija porablja oziroma se veže. Celotna energija, ki se sprošča pri nastajanju novih vezi v produktih, je nižja od celotne energije, ki se porabi pri razkroju vezi v reaktantih.
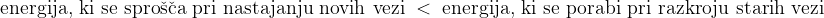
Energija ostane vezana v produktih, zato imajo produkti višjo energijo od reaktantov. Poglejmo si energetski diagram endotermne reakcije:
Diagram nam prikazuje spremembe v energiji tekom reakcije. Izhodišče diagrama postavimo v 0.
Predpostavili smo, da imamo na začetku samo reaktante (rdeča vodoravna črta) na izbranem energijskem nivoju (po dogovoru je to sedaj pri 0kJ).
Ko se prične reakcija, energija sistema narašča (molekule pridobivajo na hitrosti, pričnejo trkati med seboj).
V določenem trenutku dosežejo kritično energijo, kjer se pričnejo prekinjati vezi med reaktanti in začnejo nastajati nove vezi, ki tvorijo produkte.
Energija prične upadati in se ustali na višjem energetskem nivoju.
Razlika med energetskim stanjem produktov (modra vodoravna črta) in energetskim stanjem reaktantov (rdeča vodoravna črta) je reakcijska entalpija 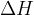 . Pri endotermni reakciji je energija produktov višja, ker se energija veže v kemijske vezi. Reakcijska entalpija je zato večja od nič:
. Pri endotermni reakciji je energija produktov višja, ker se energija veže v kemijske vezi. Reakcijska entalpija je zato večja od nič:
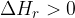
Razlika med najvišjo energetsko točko in energijo reaktantov je tako imenovana aktivacijska energija 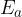 (rdeča črtkana črta). To je najnižja energija, ki jo mora sistem doseči, da se kemijska reakcija prične.
(rdeča črtkana črta). To je najnižja energija, ki jo mora sistem doseči, da se kemijska reakcija prične.
Pri eksotermnih reakcijah se energija sprošča. Celotna energija, ki se sprošča pri nastajanju novih vezi v produktih, je večja od celotne energije, ki se porabi pri razkroju vezi v reaktantih:
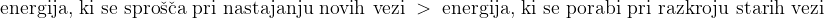
Energija se prične sproščat, zato imajo produkti nižjo energijo od reaktantov. Poglejmo si energetski diagram eksotermne reakcije:
Diagram nam prikazuje spremembe v energiji tekom reakcije. Izhodišče diagrama postavimo v 0:
Predpostavili smo, da imamo na začetku samo reaktante (rdeča črta) na izbranem energijskem nivoju (po dogovoru je to pri 0kJ).
Ko se prične reakcija, energija sistema narašča (molekule pridobivajo na hitrosti, pričnejo trkati med seboj).
V določenem trenutku dosežejo kritično energijo, kjer se pričnejo prekinjati vezi med reaktanti in začnejo nastajati nove vezi, ki tvorijo produkte.
Energija prične upadati in se ustali na nižjem energetskem nivoju.
Razlika med energetskim stanjem produktov (modra vodoravnaravna črta) in energetskim stanjem reaktantov (rdeča vodoravna črta) je reakcijska entalpija 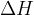 . Pri eksotermni reakciji je energija produktov nižja, ker se le-ta sprošča. Reakcijska entalpija je zato nižja od nič:
. Pri eksotermni reakciji je energija produktov nižja, ker se le-ta sprošča. Reakcijska entalpija je zato nižja od nič:
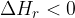
Katalizator je snov, ki v reakcijo vstopa zato, da zniža aktivacijsko energijo. Pri tem iz reakcije izstopa nespremenjen, saj ni udeležen pri kemijskih spremembah.
Poglejmo si, kaj to pomeni na energetskem nivoju:
Opišimo skico:
zelena črta: je reakcija s pomočjo katalizatorja,
črna črta: je reakcijo brez katalizatorja.
Na skici bomo opazili, da ima aktivacijska energija za katalizirano reakcijo (vijola črtkana črta) vrh pri nižji energiji. Katalizator tako pomaga, da se kemijska reakcija zgodi pri nižji aktivacijski energiji.
Katalizatorji so običajno:
kisline (žveplova (VI) kislina, dušikova (V) kislina...),
kovine (platina, svinec...),
svetloba,
spojine kot so aluminijev triklorid itd...