Osebne zbirke


Elektroliza je postopek, ki je uporaben za:
pridobivanje čistih elementov, kot na primer 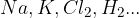 ;
;
za zaščito korozivnih kovin; temu postopku pravimo galvanizacija;
čiščenje kovin.
Tako kot pri vseh reakcijah lahko tudi pri elektrolizi izračunamo izkupiček dane reakcije. Pri tem nam pomaga Faradayev zakon, ki se ukvarja s količino snovi, ki nastane pod vplivom enosmernega toka.
Faradayev zakon za elektrolizo pravi, da je količina električnega naboja Q [As], ki steče skozi elektrolit, sorazmerna z:
množino izločene snovi, n [mol];
številu izmenjanih elektronov, z;
Faradayevi konstanti, F [As/mol].
Zakon zapišemo z enačbo:
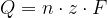
Pogosto nas zanima, koliko časa in električnega toka potrebujemo za določen tehnološki proces. Kako so med seboj povezani:
električni naboj,
električni tok,
in čas,
je podrobneje pojasnjeno v gradivu Električni tok. Tukaj samo povzemimo bistvena spoznanja. Pri tem naj nas ne zmoti, da naboj včasih označimo z e, včasih pa z Q.
Električni tok, naboj in čas so povezni z enačbo:
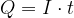
kjer je Q električni naboj, I električni tok, t pa čas.