Osebne zbirke


Ioni so električno pozitivno ali negativno nabiti delci, ki nastanejo, ko nevtralnemu atomu ali molekuli odvzamemo ali dodamo en ali več elektronov.
Če je ion:
pozitiven, ga imenujemo kation,
negativen, ga imenujemo anion.
Pri zapisu ionov zapišemo vedno tudi njegov naboj. Naboj napišemo desno zgoraj, skupaj s številom elektronov, ki jih je atom oddal ali sprejel.
Kation je pozitivno nabit delec. Nastane, ko atomu ali molekuli odvzamemo en ali več elektronov; posledično je v orbitalah manjše število elektronov kot protonov, zato je delec pozitivno nabit.
Opišimo sliko 1:
Atom, na sliki levo, je električno nevtralen, saj ima enako število elektronov kot protonov.
Ko atom odda elektron se ionizira. Število elektronov se je zmanjšalo za 1 in zato se njegov skupni negativni naboj zmanjša. Ionizirani atom je zato v tem primeru pozitivno nabit.
Ionizirani atom ima en elektron manj, zato na sliki 1 desno opazimo, da zunanjega elektrona z njegovo orbitalo ni več.
Za nastanek kationa je potrebna ionizacijska energija. Ionizacijska energija je energija, ki iztrga elektron iz atoma, odvisna pa je od tega:
v kateri orbitali se nahaja elektron
kje v orbitali se nahaja.
Vsi atomi elementov, z izjemo žlahtnih plinov, lahko tvorijo katione.
Za nastanek kationa so najugodnejši elementi prve skupine, saj imajo le ti na zunanji lupini samo 1 elektron. Več kot imajo atomi elektronov na zunanji lupini, težje atom ioniziramo. Tudi elementi tretje in četrte skupine periodnega sistema tvorijo katione, vendar je za nastanek potrebna precej višja ionizacijska energija, včasih pa brez zunanje pomoči ionizacija celo ni mogoča.
Ko ima atom polno zunanjo lupino (polno orbitalo), postane nereaktiven. Rečemo tudi, da je atom stabilen. Atomom s polno zunanjo lupino pravimo tudi žlahtni plini, ki običajno ne tvorijo ionov.
Pravzaprav vsi atomi težijo k čim bolj stabilni obliki, podobni žlahtnim plinom. Način, kako atomi dosegajo to stabilno obliko (stanje, ko je zunanja orbitala ali lupina polna), je prek ionizacije.
Atomi elementov prve skupine periodnega sistema imajo na zadnji lupini 1 elektron. Ionizacijska energija je zelo nizka, zato radi oddajo edini elektron, nastali kation je zelo stabilen. Tvorijo 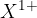 ione.
ione.
Atomi elementov druge skupine periodnega sistema, imajo na zadnji lupini 2 elektrona. Če oddajo le en elektron, je kation zelo nestabilen, zato je najbolj ugodno, da se znebijo obeh. Tvorijo 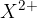 ione.
ione.
Atomi prehodnih elementov lahko tvorijo številne ione z različnim nabojem. To je tudi razlog, da v imenu elementa z rimsko številko navedemo še njego naboj.
Anion je negativno nabit delec. Nastane, ko atom ali molekula sprejme en ali več elektronov; posledično je v orbitalah večje število elektronov kot protonov, zato je delec negativno nabit. S sprejemom elektronov, se obseg lupin poveča, prav zato so anioni večji kot kationi.
Opišimo sliko 2:
Atom, na sliki levo, je električno nevtralen, saj ima enako število elektronov kot protonov.
Ko atom sprejme elektron se ionizira. Število elektronov se je poveča za 1, zato se tudi njegov skupni negativni naboj poveča. Ionizirani atom je zato v tem primeru negativno nabit.
Atomi elementov sedme skupine periodnega sistema imajo v zadnji lupini 7 elektronov. Sprejmejo lahko dodaten elektron in s tem tako zapolnijo orbitalo in vzpostavijo stabilno obliko. Tvorijo 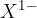 ione.
ione.
Atomi elementov šeste skupine periodnega sistema imajo v zadnji lupini 6 elektronov, do popolnjenosti orbitale jim manjkata še dva elektrona. Načeloma bi lahko sprejeli le 1 elektron, kar bi pomenilo, da bi v zunanji lupini imeli 7 elektronov, do popolnjene orbitale pa bi jim manjkal še 1 elektron. Taki ioni so nestabilni in zato v naravi redki.
Če pa sprejmejo 2 elektrona, je njihova zadnja lupina zapolnjena in tako dosežejo stabilno stanje. Zato so v naravi pogosti.
Ionizacijska energija atoma (Ei), je najmanjša energija, ki jo potrebujemo, da odvzamemo elektron atomu ali ionu v plinastem agregatnem stanju. Če atomu odvzamemo elektron, dobimo pozitivno nabit delec, kation. Enote, ki jih uporabljamo za označbo ionizacijsko energijo so eV ali kJ/mol. Nekoliko bolj splošno to obravnava tudi fizika v gradivu Elektronska stanja atomov.
Ionizacijo atoma zapišemo z enačbo tako:
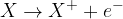
Iz enačbe lahko razberemo, da nevtralen atom na levi strani, poimenovan X, odda elektron, se ionizira in tako postane pozitivno nabit delec 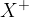 .
.
Vrednost ionizacijske energije je vedno pozitivna in večja kot je vrednost, bolj stabilen je delec. Bolj kot je elektron oddaljen od jedra, manjša je vrednost ionizacijske energije.