Osebne zbirke


Ionska vez je električni privlak med pozitivno nabitim ionom kovine in negativno nabitim ionom nekovine.
Kako in zakaj pa ti ioni nastanejo?
Atomi vseh elementov imajo enako število protonov in elektronov, zato so vsi atomi električno nevtralni. Vendar pa v tem stanju niso vedno najbolj stabilni.
Elementi so najbolj stabilni takrat, ko imajo zapolnjeno svojo zunanjo lupino z elektroni. Elementi v VIII. skupini periodnega sistema so najstabilnejši in najmanj reaktivni, saj imajo polno zasedeno zunanjo lupino.
Atomi, ki se ne nahajajo v VIII. skupini, pa nimajo zapolnjene svoje zunanje lupine, zato niso najbolj stabilni. Stabilnost lahko dosežejo tako, da od drugih atomov sprejmejo ali jim oddajo elektrone. Oddajo ali sprejmejo toliko elektronov, da je njihova zadnja lupina polna.
Ko prideta v stik kovina in nekovina, ki imata potrebo po stabilni elektronski konfiguraciji, pride do prenosa elektronov med njima.
Kovina odda svoje elektrone, nekovina pa jih sprejme. To obema atomoma omogoča, da zapolnita svojo zunanjo lupino. Delci, ki nastanejo ob oddajanju ali sprejemanju elektronov, imajo naboj. Takim delcem pravimo ioni.
Pozitivni ioni, ki nastanejo iz kovine, in negativno nabiti ioni, ki nastanejo iz nekovine, se zaradi nasprotnih nabojev povežejo. Tako nastane ionska vez.
Z ionsko vezjo se lahko povežeta le kovina in nekovina oziroma kovinski ion in nekovinski ion. Pri nastanku ionske vezi najprej atomi postanejo ioni.
Iz kovine nastane kation tako, da kovina odda elektron ali več elektronov. Iz nekovine pa nastane anion tako, da nekovina sprejme enega ali več elektronov.
Kovina torej odda elektrone nekovini. Pri tem nastanejo kationi s pozitivnimi naboji in anioni z negativnimi naboji. Zaradi nasprotnih nabojev se kationi in anioni med sabo privlačijo in se zato povežejo z vezjo, ki ji pravimo ionska vez.
Ionska vez je kemijska vez, ki povezuje ione. Gre za privlak med pozitivno nabitimi ioni kovin in negativno nabitimi ioni nekovin, ki nastanejo iz atomov kovine in nekovine.
Kadar imata kation in anion številčno enak naboj, se povezujeta v razmerju 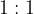 . To pomeni, da se en kation poveže z enim anionom oziroma da en atom kovine odda elektron ali elektrone enemu atomu nekovine.
. To pomeni, da se en kation poveže z enim anionom oziroma da en atom kovine odda elektron ali elektrone enemu atomu nekovine.
Kadar pa kation in anion nimata številčno enakega naboja, se povežeta v takem razmerju, da se skupni naboji izravnajo in tvorita nevtralno spojino. To pomeni, da se število kationov in anionov prilagodi tako, da je skupni pozitivni naboj kationov enak skupnemu negativnemu naboju anionov.
V ionsko spojino se poveže toliko nasprotno nabitih ionov, da je skupni naboj spojine enak 0. Razmerje števila ionov je torej takšno, da se skupni naboji izravnajo in tvorita nevtralno spojino.
Ionska vez je pogosta vez v spojinah, vendar se vsi delci ne morejo povezovati preko ionske vezi.
Ionske spojine niso majhne molekule, ampak lahko tvorijo večje strukture, ki jim pravimo ionski kristali. V ionskih kristalih število ionov ni tako pomembno, pač pa se bolj osredotočamo na razmerje med kationi in anioni.
Vse ionske spojine imajo podobne lastnosti, kot so visoka tališča in vrelišča ter dobro prevajanje električnega toka v talini ali raztopini. Več o lastnostih ionskih spojin je zapisano v gradivu Lastnosti ionskih in kovalentnih spojin.
Pri poimenovanju ionskih spojin najprej poimenujemo kation in nato anion.
Ionske spojine poimenujemo po korakih:
Zapišemo ime kovinskega kationa s slovensko osnovo.
Dodamo končnico -ev ali -ov.
Naredimo presledek in zapišemo latinsko ime aniona nekovine.
Dodamo končnico -id.
Ionske spojine so binarne spojine, zato bi pričakovali, da za njihovo poimenovanje uporabljamo grške števnike.
Grški števniki se pri poimenovanju uporabljajo za označevanje števila atomov posameznega elementa v spojinah.
Poimenovanje z grškimi števniki lahko pri poimenovanju ionskih spojin izpustimo, ker se kationi in anioni pri ionskih spojinah vedno povezujejo tako, da se izravna skupni naboj. Kakšna je formula spojine lahko sklepamo že iz sestave ionske spojine.
Ionske spojine so sestavljene iz pozitivnih kationov in negativnih anionov in ne iz molekul. Zato ionske spojine ne moremo zapisati z molekulsko formulo, pač pa zapis ionske spojine imenujemo formulska enota.
Formulska enota prikazuje razmerje med kationi in anioni v ionski spojini. Izraz formulska enota ni pogosto v uporabi. Zapisu za ionsko spojino večkrat pravimo kar formula ionske spojine.
Pri zapisu formule ionskih spojin najprej zapišemo kation, nato pa še anion.
Ko zapisujemo formule ionskih snovi, moramo vedno preveriti naboje ionov, iz katerih je ionska snov sestavljena.
Ker so ionske snovi nevtralne spojine, moramo upoštevati naboje ionov, tako da se skupni pozitivni naboj kationov in negativni naboj anionov izničita.