Osebne zbirke


Pri kemijski kinetiki preučujemo hitrost kemijske reakcije.
Hitrost kemijske reakcije je definirana kot sprememba koncentracije reaktantov ali produktov na časovno enoto.
Tekom kemijske reakcije nastajajo produkti. Njihova koncentracija s časom narašča. Zapis za hitrost tega procesa je:
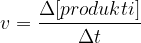
kjer je:
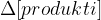 sprememba koncentracije merjena v
sprememba koncentracije merjena v 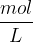 . Oglati oklepaj označuje množinsko koncentracijo, ki jo običajno označimo s c.
. Oglati oklepaj označuje množinsko koncentracijo, ki jo običajno označimo s c.
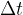 sprememba časa merjena v sekundah s.
sprememba časa merjena v sekundah s.
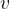 hitrost kemijske reakcije, ki jo navedemo v
hitrost kemijske reakcije, ki jo navedemo v 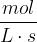 .
.
Podobno velja, če opazujemo porabo reagentov. Tekom kemijske reakcije se koncentracija reagentov zmanjšuje. Zapis za hitrost tega procesa je:
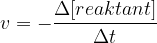
Ker se reagent porablja, bi za rezultat dobili negativno hitrost. Ker nas zanima hitrost razpada, dodamo pred enačbo minus.
Če sledimo dalj časa porabi ali nastanku molekul, opazimo, da se s časom hitrost zmanjša. Zakaj?
V gradivu Vplivi na hitrost kemijske reakcije smo povedali, da je hitrost kemijske reakcije odvisna od koncentracije. Namreč:
Tem bolj se reaktanti porabljajo, tem manj reaktantov ostaja.
Tem manj reaktantov ostaja, manjša je verjetnost, da pride do trka med molekulami.
Manj trkov med molekulami pa pomeni, da nastane manj produktov.
Celotna reakcija se prične postopoma upočasnjevati. Reakcija se umiri, ko:
se porabijo vsi reaktanti,
se vzpostavi ravnotežje (v primeru ravnotežnih reakcij).