Osebne zbirke


Videli smo, kako ionska vez med sabo poveže kovino in nekovino oziroma kovinski kation in nekovinski anion.
V tem gradivu pa se bomo posvetili povezovanju atomov nekovin. Ti pa se med seboj povezujejo s kemijsko vezjo, ki jo imenujemo kovalentna vez.
Atomi nekovin morajo doseči stabilno zgradbo, kar pomeni zapolnjeno zunanjo lupino. Nekovina pri povezovanju z drugo nekovino ne oddaja ali sprejema elektronov. Med sabo se povežejo tako, da si delijo elektrone.
To se lahko zgodil le med dvema atomoma nekovine, saj imata oba atoma podobno sposobnost privlaka elektronov. Pri kovinah pa je sposobnost privlaka majhna, zato se kovine ne povezujejo s kovalentno vezjo.
Za nastanek kovalentne vezi oba atoma nekovine darujeta elektrone v skupno vez. Deljenje elektronov pomeni, da vsak atom prispeva enega ali več svojih elektronov v skupno uporabo. Ti deljeni elektroni potem hkrati pripadajo obema atomoma. Ko si atoma delita elektrone, nastane med njima močna privlačna sila, saj oba atoma privlačita deljena elektrona.
Snovi, v katerih so atomi povezani s kovalentnimi vezmi, imenujemo molekule.
Dvoatomne molekule elementov so molekule, ki nastanejo s povezovanjem dveh atomov nekovine istega elementa. Atoma se povežeta s kovalentno vezjo, da dosežeta stabilno elektronsko konfiguracijo.
Med atomi lahko nastanejo:
enojne vezi,
dvojne vezi ali
trojne vezi.
Oba atoma v skupno vez darujeta isto število elektronov. Toliko elektronov, kot atom daruje v skupno vez, toliko elektronov tudi 'pridobi'.
Enojna vez med atomoma nastane v primerih, ko obema atomoma do zapolnjene zadnje lupine manjka le en elektron. Zato vsak od atomov daruje po en svoj elektron v skupno vez, ki je sedaj sestavljena iz enega para elektronov. Temu paru pravimo tudi skupni elektronski par.
V enojni vezi sta prisotna dva elektrona, ki si ju oba atoma delita. Lahko rečemo, da si:
prvi atom izposodi elektron drugega atoma in tako zapolni svojo lupino,
hkrati pa si drugi atom izposodi elektron prvega atom in tudi ta zapolni svojo zadnjo lupino.
Kadar rišemo strukturno formulo, enojno vez zapisujemo z enojno črtico ( ) med dvema atomoma. Vsaka črtica predstavlja en skupen elektronski par.
) med dvema atomoma. Vsaka črtica predstavlja en skupen elektronski par.
Dvojna vez med atomoma nastane v primerih, ko obema atomoma do zapolnjene zadnje lupine manjkata dva elektrona in zato v skupno vez vsak od atomov daruje dva svoja elektrona. Tako nastaneta dva skupna elektronska para.
V dvojni vezi sta prisotna dva elektronska para oziroma 4 elektroni, ki si jih oba atoma delita. Lahko rečemo, da si prvi atom izposodi elektrona drugega atoma in tako zapolni svojo lupino, hkrati pa si drugi atom izposodi elektrona prvega atom in tudi ta zapolni svojo zadnjo lupino.
Kadar rišemo strukturno formulo, dvojno vez zapisujemo z dvojno črtico ( ) med dvema atomoma. Vsaka črtica predstavlja en skupen elektronski par. Dve črtici tako predstavlja dva skupna elektronska para med atomoma.
) med dvema atomoma. Vsaka črtica predstavlja en skupen elektronski par. Dve črtici tako predstavlja dva skupna elektronska para med atomoma.
Nekovini, ki jima do zapolnjene zadnje lupine manjkata 2 elektrona sta kisik in žveplo. Atoma kisika se povežeta z dvojno kovalentno vezjo, žveplo pa se z drugimi atomi žvepla povezuje nekoliko drugače.
Trojna vez med atomoma nastane v primerih, ko obema atomoma do zapolnjene zadnje lupine manjkajo še trije elektroni in zato v skupno vez vsak od atomov daruje tri svoje elektrone. Tako nastanejo tri skupni elektronski pari.
V trojni vezi so prisotni tri elektronski pari oziroma 6 elektronov, ki si jih oba atoma delita.
Kadar rišemo strukturno formulo, trojno vez zapisujemo s trojno črtico ( ) med dvema atomoma. Vsaka črtica predstavlja en skupen elektronski par. Tri črtice tako predstavljajo tri skupne elektronske pare med atomoma.
) med dvema atomoma. Vsaka črtica predstavlja en skupen elektronski par. Tri črtice tako predstavljajo tri skupne elektronske pare med atomoma.
Nekovini, ki jima do zapolnjene zadnje lupine manjkajo 3 elektroni sta dušik in fosfor. Atoma dušika se povežeta s trojno kovalentno vezjo, fosfor pa se z drugimi atomi fosforja povezuje nekoliko drugače.
Spojine so čiste snovi, sestavljene iz dveh ali več različnih elementov. V tem delu se bomo posvetili spojinam, ki jih sestavljajo atomi nekovin.
Tudi med različnimi atomi nekovin lahko nastanejo:
enojne,
dvojne in
trojne vezi.
Z dvojno vezjo se najpogosteje z drugimi atomi povežeta kisik in žveplo, s trojno vezjo pa dušik.
Vezi med različnimi atomi nekovin nastanejo na isti način, kot vezi med atomi iste nekovine.
Podrobno si bomo pogledali še nastanek molekule vode, amonijaka in metana. Vse molekule so sestavljene iz več atomov nekovin.
Molekulska formula vode je 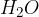 . Ena molekula je sestavljena iz dveh vodikovih atomov in enega kisikovega atoma.
. Ena molekula je sestavljena iz dveh vodikovih atomov in enega kisikovega atoma.
Kisik se nahaja v VI. skupini periodnega sistema in ima 6 valenčnih elektronov, vodik pa v I. skupini periodnega sistema in ima 1 valenčni elektron.
Na spodnji sliki je s simbolom prikazan kisik in okrog njega 6 valenčnih elektronov ter dva vodika z enim valenčnih elektronom.
Kisik ima 6 valenčnih elektronov, zato potrebuje 2 dodatna elektrona, da doseže stabilno elektronsko konfiguracijo z 8 elektroni na zadnji lupini.
Vsak vodik ima 1 valenčni elektron in mu do zapolnjene lupine manjka še 1 dodaten elektron.
Vsak vodik tako deli svoj en elektron s kisikovim atomom v skupno vez. Pri tem tudi kisikov atom daruje en elektron v skupno vez s prvim vodikom in en elektron v skupno vez z drugim vodikom.
Vsak vodik ima sedaj dva elektrona iz skupne vezi. S tem tudi kisik pridobi dva dodatna elektrona. Kisik ima tako okrog sebe še 4 elektrone, 4 elektrone pa ima iz skupnih vezi. Skupno ima 8 elektronov, zato je njegova zadnja lupina polna.
Med atomi nastaneta dve kovalentni vezi:
ena kovalentna vez nastane med kisikovim in prvim vodikovim atomom,
druga kovalentna vez pa nastane med kisikovim in drugim vodikovim atomom.
Ker je v vezi en elektronski par, bodo nastale enojne kovalentne vezi. Še enkrat narišemo molekulo vode, le da tokrat kovalentno vez ponazorimo z enojno črto. Na mestih, kjer so skupni elektronski pari, narišemo enojno črto.
Molekulska formula amonijaka je 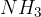 . Ena molekula je sestavljena iz enega dušikovega atoma in treh vodikovih atomov.
. Ena molekula je sestavljena iz enega dušikovega atoma in treh vodikovih atomov.
Dušik se nahaja v V. skupini periodnega sistema in ima 5 valenčnih elektronov, vodik pa v I. skupini periodnega sistema in ima 1 valenčni elektron.
Na spodnji sliki je s simbolom prikazan dušik in okrog njega 5 valenčnih elektronov ter trije vodiki z enim valenčnim elektronom.
Dušik ima 5 valenčnih elektronov, zato potrebuje 3 dodatne elektrone, da doseže stabilno elektronsko konfiguracijo z 8 elektroni na zadnji lupini.
Vsak vodik ima 1 valenčni elektron in mu do zapolnjene lupine manjka še 1 dodaten elektron.
Vsak vodik tako deli svoj en elektron z dušikovim atomom v skupno vez. Pri tem tudi dušikov atom daruje en elektron v skupno vez s prvim vodikom, en elektron v skupno vez z drugim vodikom in en elektron v skupno vez s tretjim vodikom.
Vsak vodik ima sedaj dva elektrona iz skupne vezi. S tem tudi dušik pridobi tri dodatne elektrone. Dušik ima tako okrog sebe še 2 elektrona, 6 elektronov pa ima iz skupnih vezi. Skupno ima 8 elektronov, zato je njegova zadnja lupina polna.
Nastanejo tri kovalentne vezi:
ena kovalentna vez nastane med dušikovim in prvim vodikovim atomom,
druga kovalentna vez med dušikovim in drugim vodikovim atomom,
ter tretja kovalentna vez med dušikovim in tretjim vodikovim atomom.
Ker je v vsaki vezi en elektronski par, bodo nastale enojne kovalentne vezi. Še enkrat narišemo molekulo amonijaka, le da tokrat kovalentne vezi ponazorimo z enojnimi črtami. Na mestih, kjer so skupni elektronski pari, narišemo enojne črte.
Molekulska formula metana je 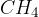 . Ena molekula je sestavljena iz enega ogljikovega atoma in štirih vodikovih atomov.
. Ena molekula je sestavljena iz enega ogljikovega atoma in štirih vodikovih atomov.
Ogljik se nahaja v IV. skupini periodnega sistema in ima 4 valenčne elektrone, vodik pa v I. skupini periodnega sistema in ima 1 valenčni elektron.
Na spodnji sliki je s simbolom prikazan ogljik in okrog njega 4 valenčni elektroni ter štirje vodiki z enim valenčnim elektronom.
Ogljik ima 4 valenčne elektrone, zato potrebuje 4 dodatne elektrone, da doseže stabilno elektronsko konfiguracijo z 8 elektroni na zadnji lupini.
Vsak vodik ima 1 valenčni elektron in mu do zapolnjene lupine manjka še 1 dodaten elektron.
Vsak vodik tako deli svoj en elektron z ogljikovim atomom v skupno vez. Pri tem tudi ogljikov atom daruje po en elektron v skupno vez s vsakim vodikom.
Vsak vodik ima sedaj dva elektrona iz skupne vezi. S tem tudi ogljik pridobi štiri dodatne elektrone. Ogljik ima tako okrog sebe še 4 elektrone, 4 elektrone pa ima iz skupnih vezi. Skupno ima 8 elektronov, zato je njegova zadnja lupina polna.
Nastanejo štiri kovalentne vezi:
ena kovalentna vez nastane med ogljikovim in prvim vodikovim atomom,
druga kovalentna vez med ogljikovim in drugim vodikovim atomom,
tretja kovalentna vez med ogljikovim in tretjim vodikovim atomom ter
četrta kovalentna vez med ogljikovim in četrtim vodikovim atomom.
Ker je v vsaki vezi en elektronski par, bodo nastale enojne kovalentne vezi. Še enkrat narišemo molekulo metana, le da tokrat kovalentne vezi ponazorimo z enojnimi črtami. Na mestih, kjer so skupni elektronski pari, narišemo enojne črte.
V enojni kovalentni vezi se nahajata dva elektrona oziroma en elektronski par. Par elektronov v vezi imenujemo tudi skupni elektronski par ali vezni elektronski par. V dvojni vezi se nahajata dva vezna elektronska para, v trojni vezi pa trije vezni elektronski pari.
Običajno atomi ne darujejo vseh svojih elektronov zadnje lupine v kovalentne vezi. Valenčnih elektroni, ki niso prisotni v kovalentni vezi tudi lahko narišemo v parih. Tak par elektronov pa imenujemo nevezni elektronski par.
Skupni ali vezni elektronski pari so pari elektronov, ki so udeleženi v kovalentni vezi.
Kovalentne vezi delimo na:
nepolarne in
polarne.
Nepolarna kovalentna vez je vez, ki nastane med dvema enakima nekovinama.
Polarna kovalentna vez pa nastane med dvema različnima nekovinama.
Pri nepolarni kovalentni vezi oba atoma nekovine isto močno privlačita elektronski par iz vezi.
Pri polarni kovalentni vezi pa običajno en atom močneje privlači elektronski par in zato naboj ni enakomerno razporejen.