Osebne zbirke


Snov je sestavljena iz osnovnih delcev - atomov. Atomi so v naravi redkokdaj prosti, zato se navadno združujejo v večje skupine - molekule. Molekule so lahko sestavljene iz atomov enake snovi ali različnih snovi. Privlačne sile, ki vežejo atome v molekule so vedno električne narave.
Atomi so razporejeni po periodičnem sistemu glede na število elektronov, ki krožijo okoli jedra. Na prvem mestu je vodik z enim elektronom. Število elektronov atoma določa zaporedno število elementa (vrstno število), njihov razpored po energetskih pasovih pa lastnosti elementa.
Enako število kot elektronov je tudi protonov v jedru. Elektroni in protoni so električno nabiti delci z nasprotno enakimi naboji, med katerimi delujejo električne sile. Poleg protonov omenimo še nevtrone v jedru. Nevtroni so električno nevtralni delci s približno enako maso kot proton. Prispevajo k masi elementa, ne vplivajo pa na kemične lastnosti elementa.
Masa elementa je pretežno v masi jedra - v protonih in nevtronih (maso elektronov za sedaj zanemarimo). Isti element ima lahko različno število nevtronov v jedru; istim atomom z različnim številom nevtronov pravimo izotop elementa. Izotopi so isti element a imajo med seboj različno maso.
Izotopi elementa so elementi, ki se med seboj razlikujejo le v številu nevtronov (in s tem v masi). Ker imajo enako število protonov v jedru (in s tem elektronov okoli jedra) se nahajajo na istem mestu v periodičnem sistemu elementov.
Iz praktičnih razlogov je smiselno, da ne merimo mas vseh elementov, pač pa jih primerjamo z enoto, ki jo imenujemo atomska enota mase u.
Znanstvena skupnost se je dogovorila, da se za atomsko enoto mase u izbere 1/12 mase ogljikovega izotopa 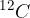 (kar je približno enako masi atoma vodika):
(kar je približno enako masi atoma vodika):
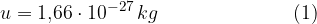
Naj bo 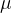 oznaka za maso atoma ali molekule. Relativna atomska masa (ali masno število) A pove, kolikokrat je masa elementa (atoma ali molekule) večja od atomske enote mase u:
oznaka za maso atoma ali molekule. Relativna atomska masa (ali masno število) A pove, kolikokrat je masa elementa (atoma ali molekule) večja od atomske enote mase u:

Če je A podana kot celo število, pomeni to relativno maso določenega izotopa elementa. Ker se v naravi pojavljajo različni izotopi istega elementa, je v periodičnem sistemu podana relativna masa povprečja izotopov v naravi. Povprečna relativna masa izotopov ogljika je 12,011, za ostale elemente pa lahko najdemo podatke v periodičnem sistemu elementov.
Maso atoma izračunamo z izrazom:
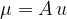
kjer je u atomska enota mase:
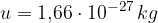
A pa relativna atomska masa.
Molekule so sestavljene iz atomov. Relativno maso molekule M glede na atomsko enoto mase u dobimo tako, da seštejemo vse relativne atomske mase A vseh atomov v molekuli:
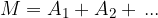
Maso molekule dobimo tako, da pomnožimo relativno maso M molekule z atomsko enoto mase:

Maso molekule izračunamo z izrazom:
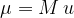
kjer je M relativna molekularna masa in u atomska enota mase:
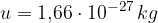
1 kilomol [kmol] snovi je ravno toliko delcev, da je njena masa enaka relativni atomski masi A če gre za atome ali M če gre za molekule. Torej:
A kg je kilomol (ali kilomolska masa), če gre za snov sestavljeno iz posameznih atomov.
M kg je kilomol (ali kilomolska masa) molekul.
Drugo pomembno dejstvo je, da je v kilomolu snovi vedno enako število molekul. To število se imenuje Avogadrovo število.
Izračunajmo Avogadrovo število. Število molekul je kilomolska masa deljeno z maso ene molekule:
Dobili smo Avogadrovo število, zato oznaki N dodamo indeks A (Avogadro).
Kilomol je enota za množino snovi. Opišemo ga lahko na dva načina:
Kilomol nam pove, koliko mnogo snovi imamo, oziroma, koliko delcev (atomov ali molekul) je v snovi. V enem kilomolu imamo natanko Avogadrovo število delcev (katerekoli) snovi.
Kilomol snovi nam pove tudi, da je v enemu kilomolu natanko toliko kg določene snovi, koliko znaša njegova relativna molekularna masa.
Število delcev (atomov ali molekul) v kilomolu (poljubne) snovi je vedno enako in se imenuje Avogadrovo število. Avogadrovo število je: