Osebne zbirke


Atom je sestavljen iz:
protonov,
elektronov in
nevtronov.
Masa atoma elementa narašča z vrstnim številom, ki nam pove, koliko protonov in elektronov je v atomu nekega elementa.
Element z manjšim vrstnim številom ima manjšo maso od elementa z višjim vrstnim številom.
Večino mase atoma sestavljajo protoni in nevtroni. Proton in nevtron imata približno enako maso, ki je okoli:
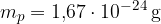
Elektron ima precej manjšo maso in jo pri navajanju mase atomov zanemarimo. Masa elektrona je približno:
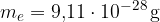
V primeru smo videli, da so mase atomov v gramih zelo majhne. Zato za navajanje mase atomov in molekul običajno ne uporabljamo gramov, ampak manjšo enoto. In ker je drugačna enota, tudi za količino izberemo drugačno ime.
Povedano malce poenostavljeno: v svetu atomov za enoto mase vzamemo maso enega protona.
Za izražanje mase atomov uporabljamo količino z imenom relativna atomska masa. Masa enega protona je torej približno enaka 1 enoti relativne atomske mase.
Za večino elementov je relativna atomska masa približno seštevek mase protonov in nevtronov, saj elektroni prispevajo zanemarljivo majhno količino mase.
Če bi tako maso elektrona (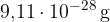 ) pretvorili v enoto relativne mase, bi videli, da je masa enega elektrona približno 0,0005 enot relativne atomske mase. To je dvatisočkrat manj od mase protona. Maso elektronov zato zanemarimo in pri relativni masi upoštevamo le mase protonov in nevtronov, ki so prisotni v jedru atoma.
) pretvorili v enoto relativne mase, bi videli, da je masa enega elektrona približno 0,0005 enot relativne atomske mase. To je dvatisočkrat manj od mase protona. Maso elektronov zato zanemarimo in pri relativni masi upoštevamo le mase protonov in nevtronov, ki so prisotni v jedru atoma.
Namesto navajanja mase atoma v gramih za navajanje mase torej raje uporabljamo relativno mero, ki jo imenujemo relativna atomska masa.
Relativna mera pomeni, da mase atomov z nečim primerjamo. Prej smo za občutek zapisali, da jo primerjamo z maso enega protona. Natančneje, za primerjalno maso je določena 1/12 mase najbolj pogostega ogljikovega izotopa, 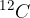 .
.
Zapišimo definicijo relativne atomske mase:
Relativna atomska masa nam pove, kolikokrat je masa določenega atoma večja od 1/12 mase atoma ogljikovega izotopa 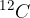 . Označimo jo z
. Označimo jo z 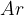 in je brez enote.
in je brez enote.
V preteklosti so se dogovorili, da je relativna atomska masa atoma ogljikovega izotopa 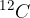 natanko 12. 1/12 relativne atomske mase tega izotopa
natanko 12. 1/12 relativne atomske mase tega izotopa 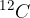 je torej 1 in zato predstavlja enoto. Z njo primerjamo mase atomov.
je torej 1 in zato predstavlja enoto. Z njo primerjamo mase atomov.
Relativno atomsko maso najdemo v periodnem sistemu elementov in sicer je ponavadi napisana nad simbolom elementa. Pazimo, da relativne atomske mase ne zamešamo z vrstnim številom elementa. Vrstno število je celo število, relativna atomska masa pa je pogosto zapisana kot decimalno število in vsebuje decimalno vejico.
Ko zapisujemo relativno atomsko maso, zapišemo znak za relativno atomsko maso in za njim navedemo še simbol elementa, za katerega je podana relativna atomska masa.
Atomi se združujejo v molekule, vendar so tudi mase molekul tako majhne, da jih ne moremo neposredno stehtati.
Tudi maso molekul zato navajamo s pomočjo relativne mere, ki jo imenujemo relativna molekulska masa. Tudi tukaj je za primerjalno maso določena masa 1/12 mase ogljikovega izotopa.
Poglejmo si definicijo relativne molekulske mase:
Relativna molekulska masa nam pove, kolikokrat je masa določene molekule večja od 1/12 mase atoma ogljikovega izotopa 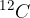 . Označimo jo z
. Označimo jo z 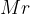 in je brez enote.
in je brez enote.
Relativne molekulske mase niso zapisane v periodnem sistemu elementov, ampak jih izračunamo iz relativnih atomskih mas elementov, iz katerih je molekula sestavljena. To naredimo tako, da seštejemo relativne atomske mase vseh elementov, ki sestavljajo molekulo.
Ko računamo vrednosti relativnih molekulskih mas, se lahko vrednosti rahlo razlikujejo, ker je vrednost relativnih atomskih mas odvisna od tega, kateri periodni sistem elementov uporabljamo.