Osebne zbirke


Zamislimo si kilogramsko utež železa. Ta utež je, tako kot vsaka druga snov, sestavljena iz delcev - atomov. Vprašamo se, iz koliko atomov železa je sestavljena. Število delcev v uteži podamo s količino, ki jo imenujemo množina snovi.
Tako, kot vsaka merska enota v kemiji, ima tudi množina snovi svojo enoto. Imenujemo jo mol.
V nadaljevanju bomo podrobneje spoznali enoto "mol" in kako določimo število delcev ter število molov.
Podobno kot je kilometer večja enota od metra, je tudi mol večja enota za opisovanje števila delcev. En mol predstavlja veliko množico (gručo) delcev. Natančneje, en mol katerekoli snovi vsebuje:
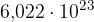
delcev. Ker enota mol vsebuje veliko število delcev, jo običajno uporabljamo za opisovanje števila:
atomov,
ionov,
molekul,
saj teh delcev že v majhnih masah snovi najdemo veliko število.
Enota mol je osnovna merska enota in zato množino snovi izražamo s številom molov. Množino snovi označimo s črko:
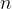
Videli smo, da vsak mol snovi vsebuje 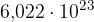 delcev. Temu številu pravimo Avogadrovo število, ki je dobilo ime po italijanskem plemiču in znanstveniku Amedeu Avogadru.
delcev. Temu številu pravimo Avogadrovo število, ki je dobilo ime po italijanskem plemiču in znanstveniku Amedeu Avogadru.
Avogadrovo število je enako 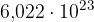 .
.
Ne glede na to, katero snov opisujemo, pa predstavlja 1 mol vselej isto število delcev. Poglejmo si enostaven primer iste množine železa in kisika.
Ker so pri različnih snoveh gradniki lahko med seboj različni, moramo vedno navesti vrsto delcev, o katerih govorimo (atomi, ioni ali molekule).
Avogadrova konstanta je tesno povezana z Avogadrovim številom:
če je Avogadrovo število le številka (in brez enote!),
je Avogadrova konstanta fizikalna konstanta, ki podaja število delcev v enem molu snovi - zato ima tudi primerno fizikalno enoto.
Avogadrovo konstanto označimo z:
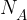
Njena enota pa je:
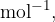
kar pomeni "delcev na mol". Zapišimo v celoti:
Avogadrova konstanta je enaka:
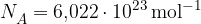
Vemo, koliko delcev je v vsakem molu snovi. Zato lahko izračunamo, koliko delcev je v nekaj molih snovi.
Iz zgornjega primera vidimo, da lahko z Avogadrovo konstanto izračunamo, koliko delcev vsebuje poljubna množina snovi. Število delcev izračunamo po enačbi:
Število delcev 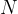 v neki snovi je enako:
v neki snovi je enako:
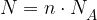
pri čemer je:
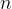 množina snovi, izražena v molih
množina snovi, izražena v molih
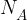 pa Avogadrova konstanta.
pa Avogadrova konstanta.
Molska masa nam pove, kakšno maso ima en mol neke snovi. Ker so snovi sestavljene iz različnih atomov ali molekul, imajo tudi različno molsko maso.
Molsko maso označimo z:
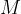
Njena enota pa je "gram na mol":
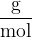
V nadaljevanju si poglejmo, kako določimo molsko maso snovi. Ker imajo snovi različne gradnike, si posebej poglejmo, kako določimo:
molsko maso elementov,
molsko maso molekul.
Element je snov, ki je sestavljena iz atomov, pri čemer so vsi atomi ene same vrste. Zato je tudi molska masa elementa enaka masi enega mola enakih atomov.
Elementi sestavljajo periodni sistem elementov. Periodni sistem elementov povzema osnovne informacije o vseh elementih - med njimi tudi o njihovi molski masi.
Molska masa elementa predstavlja molsko maso čiste snovi oziroma atomov. Količina je podana z enoto:
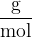
Molska masa vsakega elementa je navedena v periodnem sistemu elementov.
Najmanjšo molsko maso ima vodik (1,00079 g/mol), ki stoji na prvem mestu. Največjo molsko maso pa ima element livermorium (298 g/mol), ki ga najdemo na čistem dnu periodnega sistema.
Nekatere snovi so sestavljene iz molekul, ne iz posameznih atomov. Ko govorimo o molski masi takih snovi, govorimo o molski masi njenih molekul. Molska masa molekule nam pove, kakšno maso ima en mol enakih molekul.
Molekule pa so lahko sestavljene iz:
enakih atomov,
različnih atomov.
Posebej si poglejmo, kako določimo molsko maso prvih in drugih.
Ko se med seboj povežejo enaki atomi, dobimo molekulo, ki je sestavljena le iz atomov ene vrste.
Molekula je težja od posameznega atoma, zato ima tudi večjo molsko maso. Molsko maso takih molekul dobimo tako, da pomnožimo:
molsko maso M elementa, iz katerega je molekula sestavljena in
število atomov N v molekuli.
Molekule so lahko sestavljene tudi iz različnih atomov.
Molsko maso takih molekul pa dobimo tako, da seštejemo molske mase posameznih elementov.
Za vsako snov lahko izračunamo njeno množino, če poznamo njeno:
maso in
molsko maso.
Množino snovi izračunamo po enačbi:
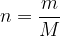
pri čemer je:
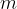 masa snovi, ki je izražena v gramih,
masa snovi, ki je izražena v gramih,
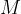 molska masa snovi, izražena v gramih na mol.
molska masa snovi, izražena v gramih na mol.
Poglejmo, kako izračunamo množino snovi, ki je sestavljena iz:
enakih atomov (element),
molekul.
Če je snov element, potem z množino snovi povemo, koliko atomov sestavlja to snov.
Za izračun množine elementa z maso m, uporabimo zgornjo enačbo:
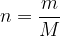
Molsko maso M elementa pa preberemo neposredno iz periodnega sistema elementov.
Izračunajmo množino za primer železa.
Ko je naša snov sestavljena iz molekul, potem z množino snovi povemo, koliko molekul sestavlja to snov. Tudi množino takih snovi izračunamo z zgornjo enačbo:
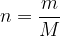
Izračun za množino molekul se le malce razlikuje od izračuna množine elementa. Molske mase molekule namreč ne moremo prebrati neposredno iz periodnega sistema, pač pa jo moramo najprej izračunati.