Osebne zbirke


Plinska enačba povezuje:
tlak,
volumen,
temperaturo
idealnega plina.
Idealni plin smo spoznali že v poglavju Toplota in temperatura. To je dovolj razredčen plin, kjer smatramo, da so medmolekularne sile dovolj majhne, da jih lahko zanemarimo. Molekule plina si predstavljamo kot toge kroglice, ki trkajo med sabo in ob steno posode. Idealni plin je v večini primerov dovolj dober približek realnega plina, kjer naštete predpostavke veljajo le delno.
Poleg tlaka, volumna in temperature v plinski enačbi srečamo veličine, ki so nam znane iz kemije. Da si olajšamo razumevanje plinske enačbe, jih ponovimo.
Atomska enota mase u je 1/12 mase ogljikovega izotopa 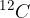 . To je približno enako masi atoma vodika:
. To je približno enako masi atoma vodika:
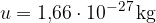
Relativna atomska masa (ali molekularna masa) M nam pove, kolikokrat je masa elementa (atoma ali molekule)  večja od atomske enote mase u.
večja od atomske enote mase u.

Relativna masa M je zapisana v periodnem sistemu elementov ob vsakem elementu. V primeru molekule, M izračunamo tako, da seštejemo relativne mase atomov, iz katerih je sestavljena molekula. Relativna atomska masa  pa je konstanta in znaša:
pa je konstanta in znaša:
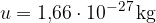
Maso molekule ali atoma izračunamo z:
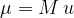
kjer je M relativna atomska masa in u atomska enota mase:
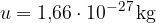
Enota za množino snovi je mol. V enemu molu katerekoli snovi je vedno enako število delcev (atomov ali molekul) in sicer:
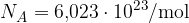
Število 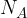 imenujemo Avogadrovo število.
imenujemo Avogadrovo število.
Namesto mola v fiziki običajno uporabljamo večjo enoto kmol. Kilomol ima 1000-krat več delcev snovi, torej:
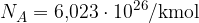
Avogadrovo število 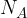 nam pove, da je v enem kilomolu (katerekoli) snovi število delcev vedno enako:
nam pove, da je v enem kilomolu (katerekoli) snovi število delcev vedno enako:
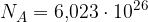
Razmislimo z drugega zornega kota. Snov je sestavljena iz delcev. Več kot je delcev, več je snovi. Ker nam mol pove, koliko delcev obsega snov, je mol enota za množino snovi oziroma enota, ki nam pove, koliko je snovi.
Molska masa je masa enega mola oziroma celotna masa 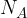 delcev. Enota je 1 g/mol.
delcev. Enota je 1 g/mol.
Ker se atomi in molekule različnih snovi med seboj razlikujejo v masi, bodo tudi molske mase snovi med seboj različne. Molska masa je določena z relativno atomsko maso M.
Iz primera vidimo, da je enota g/mol enaka enoti kg/kmol (števec in imenovalec v enoti smo množili s 1000). V fiziki, kjer za osnovne enote uporabljamo meter, kilogram in sekundo, posledično običajno uporabljamo tudi enoto 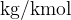 .
.
Razlika med molsko maso in relativno atomsko maso.
Čeprav molsko maso in relativno atomsko maso označimo z isto črko M in imata obe enako številsko vrednost, se pojma razlikujeta v enoti in pomenu.
Molska masa ima enoto kg/kilomol in nam pove, kakšna je masa enega kilomola snovi - to je Avogadrovega števila delcev snovi.
Relativna atomska masa nima enote. Pove nam, kolikokrat ima delec snovi večjo maso od atomske enote mase u:
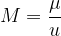
Koliko kilomolov določene snovi imamo, označimo z n:

Enota za maso je kg, enota za M pa kg/kmol.
Število atomov (ali molekul) v opazovani množini snovi označimo z N.
Če smo pri definiciji mola napisali, da ima 1 mol snovi natančno Avogadrovo število 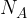 delcev (atomov ali molekul), velja, da ima n molov n-krat več molekul:
delcev (atomov ali molekul), velja, da ima n molov n-krat več molekul:

Pri izračunu števila atomov ali molekul v opazovani snovi pa lahko tudi preprosto delimo celotno maso snovi m z maso ene same molekule ali atoma 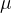 :
:

Predno so zapisali končno obliko plinske enačbe, so z meritvami prišli do delnih spoznanj, kako so soodvisni tlak, volumen in temperatura plinov. To so Boylov zakon in Gay-Lussacov zakon.
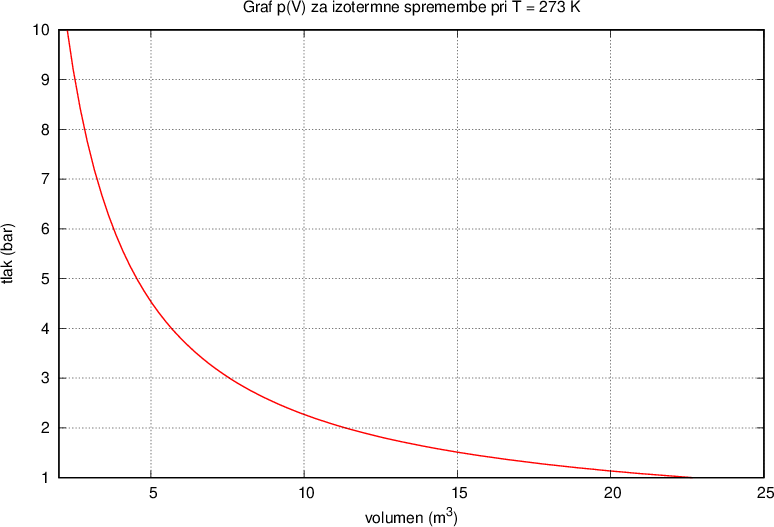
Imamo določeno množino plina (t. j. število kilomolov), ki ga stiskamo ali razpenjamo npr. s pomočjo bata v zaprtem valju. Ko bat stisnemo, se volumen plina zmanjša in tlak poveča, njun produkt pa ostaja konstanten. Paziti moramo le, da se spremembe vršijo pri stalni temperaturi - izotermne spremembe.

Boylov zakon pravi, da pri konstantni temperaturi, in ob upoštevanju predpostavke idealnega plina, velja:
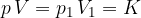
kjer 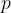 in
in 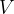 določata stanje plina pred spremembo,
določata stanje plina pred spremembo, 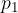 ,
, 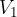 stanje plina po spremembi,
stanje plina po spremembi, 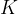 pa je konstanta.
pa je konstanta.
Narišimo graf p(V) za kilomol plina pri izotermnih spremembah (T=273 \, \text{K}). Konstanto K bomo znali izračunali kasneje, sedaj napišimo, da je konstanta 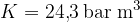 .
.
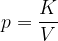
Vzemimo podoben primer zaprtega valja in enako množino plina. Sedaj valj segrevamo. Plin se s temperaturo razpenja in odriva bat. Tlak v posodi ostaja konstanten, spremembam pravimo izobarne spremembe. Opazimo, da količnik med volumnom in temperaturo ostaja konstanten:

Gay-Lussacov zakon pravi, da pri konstantnem tlaku, in ob upoštevanju predpostavke idealnega plina, velja:
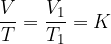
kjer 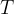 in
in 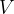 določata stanje plina pred spremembo,
določata stanje plina pred spremembo, 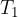 ,
, 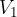 stanje plina po spremembi,
stanje plina po spremembi, 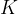 pa je konstanta.
pa je konstanta.
Narišimo graf V(T) za izobarne spremembe (p=1,01 bar). Konstanto K bomo znali izračunali kasneje, sedaj napišimo, da je za kilomol plina konstanta 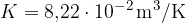 .
.
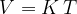
Vzemimo primer zaprtega valja s kilomolov plina. Valj s plinom segrevamo. Plinu raste temperatura in tlak, volumen ostane nespremenjen. Spremembam pravimo izohorne spremembe. Količnik med tlakom in temperaturo ostaja med segrevanjem konstanten:

Amontonsov zakon pravi, da pri konstantnem volumnu in ob upoštevanju predpostavke idealnega plina, velja:
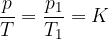
kjer 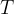 in
in 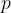 določata stanje plina pred spremembo,
določata stanje plina pred spremembo, 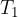 ,
, 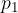 stanje plina po spremembi,
stanje plina po spremembi, 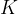 pa je konstanta.
pa je konstanta.
Narišimo graf p(T) za izohorne spremembe (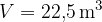 ). Konstanto K bomo znali izračunali kasneje, sedaj napišimo, da je za kilomol plina enaka
). Konstanto K bomo znali izračunali kasneje, sedaj napišimo, da je za kilomol plina enaka 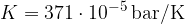 .
.
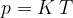
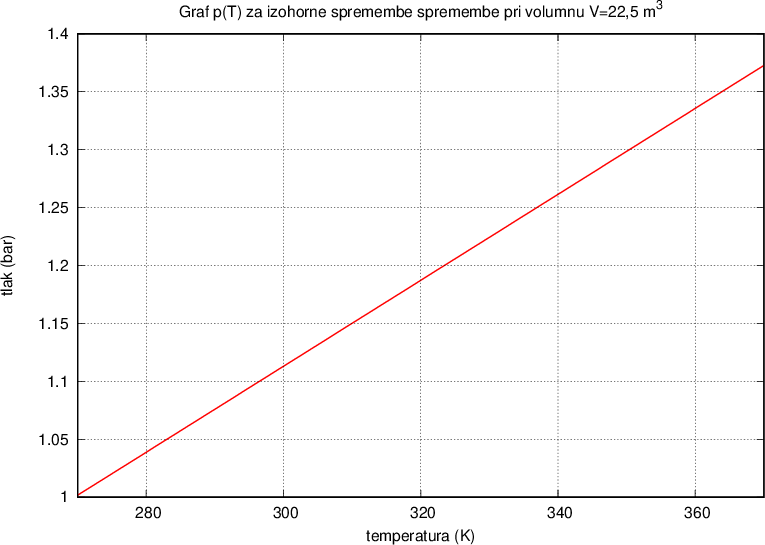
Združimo spoznanja, zajeta v enačbah (4), (5) in (6):
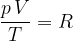
Enačba velja za kilomol poljubnega plina. Konstanta R, ki smo jo zapisali, je splošna plinska konstanta:
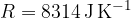
Če imamo n kilomolov poljubnega plina, se plinska enačba glasi:
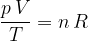
kjer je n - glej enačbo (2):
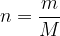
Zapišimo plinsko enačbo še v drugi obliki:
Plinska enačba povezuje tlak, volumen in temperaturo idealnega plina. Velja kot zadosti dober približek tudi za realne pline. Zapomnimo si jo v dveh oblikah:
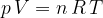
kjer je n število kilomolov in R splošna plinska konstanta.
Druga oblika plinske enačbe je:
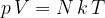
kjer je N število molekul in k Boltzmanova konstanta.
Plin je velikokrat sestavljen iz molekul različnih elementov, kot na primer zrak. Ta je sestavljen iz pretežno iz dušika (78 %) in kisika (21 %). V majhnih deležih so prisotni v zraku ogljikov dioksid, vodna para in plemeniti plini (argon).
Vzemimo plin, kjer je število posameznih elementov 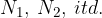 . Vsi elementi imajo isto temperaturo in so razporejeni v celotnem razpoložljivem volumnu. K celotnemu tlaku prispeva vsak plin svoj delni tlak.
. Vsi elementi imajo isto temperaturo in so razporejeni v celotnem razpoložljivem volumnu. K celotnemu tlaku prispeva vsak plin svoj delni tlak.
Tlak prvega elementa je npr.
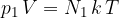
drugega elementa:
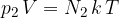
Celoten tlak plina je enak vsoti delnih tlakov:
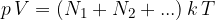
Delni tlaki so torej sorazmerni številu molekul, niso pa odvisni od velikosti ali mase molekule. Napisana enačba se imenuje Daltonov zakon.
Daltonov zakon pravi, da je delni tlak posameznih molekul ali atomov v zmesi plina sorazmeren številu elementov v opazovanem volumnu in od temperature.
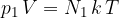
oziroma
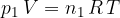
kjer je 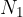 število molekul oziroma
število molekul oziroma 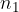 število kilomolov opazovanega plinskega elementa.
število kilomolov opazovanega plinskega elementa.