Osebne zbirke


Kot že vemo, je konstanta ravnotežja 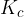 količnik med:
količnik med:
zmnožkom ravnotežnih koncentracij produktov in
zmnožkom ravnotežnih koncentracij reaktantov.
Če poznamo množinske koncentracije [mol/L] posameznih spojin, lahko preračunamo ravnotežne konstante. Ker je koncentracija reaktantov in produktov podvržena vplivu temperature, so tudi konstante ravnotežja 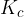 odvisne od le-te. Torej, ko navajmo konstante ravnotežja, vedno navedemo tudi temperaturo, pri kateri se vzpostavi dotično ravnotežje. Pri tem je potrebno upoštevati, da se ravnotežne reakcije se vzpostavijo v zaprtem prostoru (volumen je konstanten).
odvisne od le-te. Torej, ko navajmo konstante ravnotežja, vedno navedemo tudi temperaturo, pri kateri se vzpostavi dotično ravnotežje. Pri tem je potrebno upoštevati, da se ravnotežne reakcije se vzpostavijo v zaprtem prostoru (volumen je konstanten).
Ko se prične reakcija, se količina reaktantov zmanjšuje, saj se porabljajo za tvorbo produktov. Začetne koncentracije reaktantov so zato različne od koncentracije reaktantov v ravnotežju (to je končnega ravnotežja).
Poglejmo si natančneje. Naj bo dana reakcija:
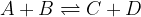
Na levi strani enačbe (A + B) nastopajo reaktanti, na desni strani (C + D) pa produkti. V tabelo zapišimo količino reaktantov in produktov ob začetku, med vzpostavljanjem ravnotežja in ob koncu reakcije, ko se vzpostavi ravnotežje:
S pomočjo tabele opišimo, kako kemijska reakcija doseže ravnotežje.
Ob začetku sta bila prisotna samo reaktanta A in B; zato je količina produktov C in D na začetku enaka 0.
Kemijska reakcija povzroči, da se del reaktantov pretvarja v produkte. V nekem trenutku je produktov x, količina reaktantov pa je, v primerjavi z začetno količino, zmanjšana za x.
Ko je ravnotežje vzpostavljeno, se koncentracije ne spreminjajo več, zato lahko natančno določimo posamezne vrednosti:
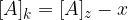
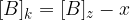
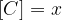
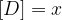
Ko se vzpostavi ravnotežna reakcija, lahko zapišemo konstanto ravnotežja in sicer:
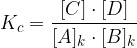
Poglejmo na praktičnem primeru, kako naredimo izračun.
Če poznamo ravnotežno konstanto in eno izmed koncentracij, lahko izračunamo vse preostale ravnotežne koncentracije. Poglejmo postopek na teoretičnem primeru:
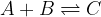
Naredimo si tabelo z znanimi količinami:
Če si natančneje pogledamo tabelo, ugotovimo:
V teoretičnem primeru je množinsko razmerje med posameznimi količinami 1 : 1 : 1
Na začetku nimamo produkta, ampak samo določeno koncentracijo reaktantov.
Kemijska reakcija povzroči, da se reaktanti pretvarjajo v produkte. V nekem trenutku je produktov x, količina reaktantov pa je, v primerjavi z začetno količino, zmanjšana za x.
Ko je ravnotežje vzpostavljeno, se koncentracije ne spreminjajo več, zato lahko natančno določimo posamezne vrednosti:
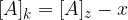
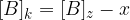
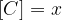
Če upoštevamo, da je x enako 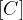 , potem lahko našo konstanto zapišemo kot:
, potem lahko našo konstanto zapišemo kot:
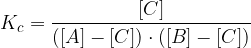
Ko imamo enkrat zapis konstante, lahko matematično izpostavimo iskano količino.
V primeru, ko je konstanta ravnotežja 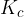 izredno majhna (pod 1), si lahko računanje poenostavimo. V imenovalcu konstante opustimo koncentracijo produkta. Pri tem je približek rezultata blizu realne vrednosti.
izredno majhna (pod 1), si lahko računanje poenostavimo. V imenovalcu konstante opustimo koncentracijo produkta. Pri tem je približek rezultata blizu realne vrednosti.
Poglejmo na praktičnem primeru, kako naredimo izračun.