Osebne zbirke


Ko neka reakcije doseže ravnotežje, se koncentracije produktov in reaktantov ne spreminjajo več in ostajajo konstante. To stanje imenujemo ravnotežna kemijska reakcija. Zanjo je značilno, da je nastanek produktov iz reaktantov enako hiter kot razpad produktov nazaj v reaktante. Torej ravnotežna kemijska reakcija nenehno poteka v obe smeri, zato pravimo, da se vzpostavi dinamično ravnotežje med reaktanti in produkti.
Ko ravnotežno kemijsko reakcijo pišemo, jo, da bi poudarili ravnotežje, zapišemo z obojesmerno puščico:
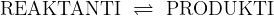
Ravnotežna reakcija je dinamično stanje. V ravnotežni reakciji produkti nenehno nastajajo, toliko, kolikor jih nastane, pa jih tudi razpade. Kot posledica v ravnotežnem sistemu se koncentracije reaktantov in produktov ohranjajo.
Homogeno ravnotežje je tisto ravnotežje, pri katerem so vse snovi v enakih agregatnih stanjih.
Heterogeno ravnotežje je tisto ravnotežje, pri katerem so udeležene snovi v različnih agregatnih stanjih.
Pri ravnotežnih reakcijah je razmerje med množinskimi koncentracijami posameznih snovi (reaktantov in produktov) pri določeni temperaturi konstantno. Slednje lahko izražamo z ravnotežno konstanto.
Ravnotežna konstanta 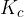 je izraz, ki predstavlja razmerje med množinskimi koncentracijami produktov in reaktantov.
je izraz, ki predstavlja razmerje med množinskimi koncentracijami produktov in reaktantov.
Tako je za ravnotežno reakcijo:
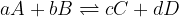
zapis ravnotežne konstante enak:
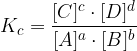
Ravnotežna konstanta nima enot. Posamezne množinske koncentracije izražene z oglatimi oklepaji ([ ]), pa so v mol / L (mol na liter). Visoka vrednost konstante nakazuje prevlado produktov (ravnotežje je premaknjeno v dobrobit nastanka produktov). Nizka vrednost ravnotežne konstante pa nakazuje prevlado reaktantov (ravnotežje je pomaknjeno v smer reaktantov).
V heterogeni ravnotežnih reakcijah poleg plinov sodelujejo tudi trdne snovi ali tekočine. V tem primeru v izraz za konstanto ravnotežja vpišemo samo koncentracije plinastih snovi.