Osebne zbirke


Toplotno ravnovesje snovi je stanje, ko imajo vsi delci snovi isto temperaturo oziroma isto kinetično energijo (za toploto in kinetično energijo delcev snovi glej Toplota in temperatura. Pogoj za ravnovesno stanje je tudi, da ni zunanjega vira toplote niti toplotnih izgub. Dosežemo ga v toplotno izolirani posodi, imenovani kalorimeter. Značilno za kalorimeter je, da so v času meritve toplotne izgube zanemarljive.
Ravnovesno stanje moramo ločiti od stacionarnega stanja.
Ravnovesno stanje se vzpostavi v toplotno izolirani posodi - kalorimetru, v katerega smo dali npr. dve snovi na različnih temperaturah. Toplejša snov odda enako toplote kot jo hladnejša sprejme. Po določenem času imajo vsi delci snovi isto temperaturo, ki ji pravimo zmesna temperatura.
Pri stacionarnem stanju opazovana snov ni toplotno izolirana, pač pa toplota neprestano priteka v snov in enaka toplota tudi odteka - glej Prevajanje toplote. Primer stacionarnega stanja je stalna temperatura v zaprtem, ogrevanem prostoru v zimskem času. Toplota, ki jo oddaja peč v opazovanem času je enaka toploti, ki prehaja skozi stene proti zunanjemu zraku, ki je na nižji temperaturi.Tudi v tem primeru imajo lahko vse molekule zraka v notranjem prostoru enako temperaturo, ki pa je posledica enakosti pritekajoče in odtekajoče toplote.
Vzemimo dve snovi z različnima specifičnima toplotama, masama in temperaturama. Damo ju v toplotno izolirano posodo, ki je pravimo kalorimeter in počakamo, da se vzpostavi toplotno ravnovesje. Predpostavimo, da se med vzpostavljanjem toplotnega ravnovesja ne bo spreminjalo agregatno stanje - faza snovi (trda, tekoča, plinasta).
Snov, ki je na višji temperaturi (glej slika 1):
ima temperaturo 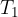 , maso
, maso 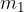 in specifično toploto
in specifično toploto 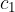 in
in
oddaja toploto snovi na nižji temperaturi in se ohlaja.
Snov, ki je na nižji temperaturi (glej slika 1):
ima temperaturo 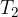 , maso
, maso 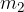 in specifično toploto
in specifično toploto 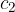 in
in
prejema toploto in se ogreva.
Toplota prehaja iz toplejše snovi na hladnejšo vse dokler se ne vzpostavi toplotno ravnovesje. Takrat so vsi delci snovi na isti temperaturi. Imenujmo jo zmesna temperatura 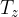 .
.
Notranja energija se ne spremeni, saj ni od zunaj dovedene toplote in zunanjega dela:
Kalorimeter je toplotno izolirana posoda. Če damo v kalorimeter več snovi na različnih temperaturah, se po določenem času vzpostavi toplotno ravnovesje - delčki vseh snovi so na isti temperaturi.
Ker ni zunanjega vira toplote ali dela velja zakon o ohranitvi energije:
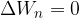
Oddana toplota je enaka prejeti toploti:
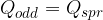
O faznih prehodih govorimo, ko snov pri segrevanju (ali ohlajevanju) prehaja iz trdnega v kapljevinasto stanje, iz kapljevinastega v plinasto stanje ali obratno.
Pri faznih prehodih je značilno, da snov ostaja na isti temperaturi vse dokler v celoti ne preide v drugo stanje. To temperaturo imenujemo temperaturo tališča in temperaturo vrelišča.
Toplota, ki jo potrebujemo, da maso m snovi v trdnem stanju, ki je že na temperaturi tališča popolnoma stalimo, izračunamo po enačbi:
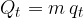
kjer je 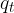 specifična talilna toplota.
specifična talilna toplota.
Toploto, ki je potrebna, da masa m snovi v kapljevinastem stanju, ki je že na temperaturi vrelišča popolnoma izpari, izračunamo po enačbi:
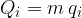
kjer je 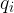 specifična izparilna toplota.
specifična izparilna toplota.
V kalorimeter lahko damo snovi v različnih faznih stanjih in na različnih temperaturah. Med vzpostavljanjem ravnovesnega stanja lahko prehaja posamezna snov iz enega stanja na drugo. Tudi v tem primeru velja, da odda snov, ki je na višji temperaturi, toploto snovi na nižji temperaturi. Oddana toplota je enaka sprejeti toploti:
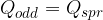
Pri sprejemanju ali oddajanju toplote lahko prehaja snov iz enega faznega stanja v drugo. Pri nalogah iz tega poglavja je poleg vprašanja o zmesni temperaturi možno tudi vprašanje, v katerem stanju je snov po vzpostavitvi toplotnega ravnovesja.
Naloge se lahko lotimo tako, da:
najprej pogledamo, koliko toplote bi oddalo toplo telo, če bi se ohladilo na neko izbrano temperaturo npr. 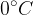
nato pogledamo, koliko toplote potrebujemo, da segrejemo hladno telo na isto temperaturo.
Če je razlika pozitivna:
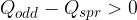
z ostankom toplote zmes snovi ponovno dogrejemo na zmesno temperaturo.
Če je razlika negativna,
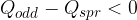
moramo skupni masi ponovno odvzeti toploto in pogledati, kaj dobimo.