S spreminjanjem teh dejavnikov zrušimo ravnotežje in s tem aktivno vplivamo na podano reakcijo.
La Chatelierovo načelo
V kolikor spremenimo enega izmed naštetih dejavnikov:
spremenimo tudi ravnotežje. Sprememba se odrazi v reakciji tako, da proizvede ali pa razgradi produkte reakcije, pri tem pa se vzpostavi novo ravnotežno stanje.
La Chatelierov princip: sprememba v ravnotežnem sistemu povzroči premik ravnotežja v smeri, ki dano spremembo minimizira.
V nadaljevanju si oglejmo La Chatelierov princip bolj podrobno, ko spreminjamo enega izmed parametrov:
Vplivi tlaka na kemijsko ravnotežje
S spremembo tlaka lahko vplivamo samo na kemijsko ravnotežje plinastih spojin. Pri tem lahko vplivamo samo na tiste ravnotežne reakcije, kjer se vsota koeficientov plinastih reaktantov razlikuje od vsote koeficientov plinastih produktov.
Oglejmo si praktične primere, pri katerih lahko oziroma ne moremo vplivati.
Primer
Primer je brezplačno dostopen prijavljenim uporabnikom.
Prijavi se za brezplačen dostop do primera »
Za brezplačen dostop do primera je potrebno izpolniti svoj profil.
Popolni svoj profil »
Primer
Primer je brezplačno dostopen prijavljenim uporabnikom.
Prijavi se za brezplačen dostop do primera »
Za brezplačen dostop do primera je potrebno izpolniti svoj profil.
Popolni svoj profil »
Vpliv povečanja tlaka
Pri povečanju tlaka sistem reagira tako, da se ravnotežje premakne v tisto smer, kjer je manj delcev. Enako kot povečanje tlaka deluje zmanjšanje volumna: namreč, ko zmanjšamo volumen, dejansko povečujemo tlak v sistemu.
Primer
Primer je brezplačno dostopen prijavljenim uporabnikom.
Prijavi se za brezplačen dostop do primera »
Za brezplačen dostop do primera je potrebno izpolniti svoj profil.
Popolni svoj profil »
Primer
Primer je brezplačno dostopen prijavljenim uporabnikom.
Prijavi se za brezplačen dostop do primera »
Za brezplačen dostop do primera je potrebno izpolniti svoj profil.
Popolni svoj profil »
Vpliv znižanja tlaka
Pri znižanju tlaka sistem reagira tako, da se ravnotežje premakne v tisto smer, kjer je več delcev. Enako kot znižanje tlaka deluje povečanje prostornine, namreč: ko povečamo volumen, dejansko znižujemo tlak v sistemu.
Primer
Primer je brezplačno dostopen prijavljenim uporabnikom.
Prijavi se za brezplačen dostop do primera »
Za brezplačen dostop do primera je potrebno izpolniti svoj profil.
Popolni svoj profil »
Primer
Primer je brezplačno dostopen prijavljenim uporabnikom.
Prijavi se za brezplačen dostop do primera »
Za brezplačen dostop do primera je potrebno izpolniti svoj profil.
Popolni svoj profil »
Vplivi spremembe temperature na kemijsko ravnotežje
Vse kemijske reakcije so podvržene vplivu temperature. Vendar pa pri posameznih reakcijah moramo vedeti ali so le-te eksotermne (sproščajo energijo) ali endotermne (vežejo energijo).
Povečanje temperature in njen vpliv na ravnotežno reakcijo
Povečanje temperature pomeni, da reakciji dovajamo energijo. Pri endotermnih reakcijah (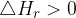 ) je potrebno dovajanje energije, zato da se tvorijo produkti. Torej pri dvigu temperature premaknemo ravnotežje v smer tvorbe produktov. Ravno nasprotno je pri eksotermnih reakcijah. Ker se pri eksotermnih reakcijah energija sprošča (
) je potrebno dovajanje energije, zato da se tvorijo produkti. Torej pri dvigu temperature premaknemo ravnotežje v smer tvorbe produktov. Ravno nasprotno je pri eksotermnih reakcijah. Ker se pri eksotermnih reakcijah energija sprošča (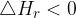 ), dovajanje dodatne energije preusmeri reakcijo v smer nastajanja reaktantov.
), dovajanje dodatne energije preusmeri reakcijo v smer nastajanja reaktantov.
Primer
Primer je brezplačno dostopen prijavljenim uporabnikom.
Prijavi se za brezplačen dostop do primera »
Za brezplačen dostop do primera je potrebno izpolniti svoj profil.
Popolni svoj profil »
Primer
Primer je brezplačno dostopen prijavljenim uporabnikom.
Prijavi se za brezplačen dostop do primera »
Za brezplačen dostop do primera je potrebno izpolniti svoj profil.
Popolni svoj profil »
Znižanje temperature in njen vpliv na ravnotežno reakcijo
Znižanje temperature pomeni, da reakciji odvajamo energijo. Pri endotermnih reakcijah (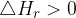 ) je potrebno dovajanje energije, zato da se tvorijo produkti. Torej pri znižanju temperature premaknemo ravnotežje v smer tvorbe reaktantov. Pri pri eksotermnih reakcijah se energija sprošča (
) je potrebno dovajanje energije, zato da se tvorijo produkti. Torej pri znižanju temperature premaknemo ravnotežje v smer tvorbe reaktantov. Pri pri eksotermnih reakcijah se energija sprošča (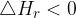 ), znižanje temperature preusmeri reakcijo v smer nastajanja produktov.
), znižanje temperature preusmeri reakcijo v smer nastajanja produktov.
Primer
Primer je brezplačno dostopen prijavljenim uporabnikom.
Prijavi se za brezplačen dostop do primera »
Za brezplačen dostop do primera je potrebno izpolniti svoj profil.
Popolni svoj profil »
Primer
Primer je brezplačno dostopen prijavljenim uporabnikom.
Prijavi se za brezplačen dostop do primera »
Za brezplačen dostop do primera je potrebno izpolniti svoj profil.
Popolni svoj profil »
Vplivi spremembe koncentracije snovi na kemijsko ravnotežje
V kemijsko reakcijo lahko dodajamo ali odvzemamo snovi. S tem spreminjamo koncentracijo posameznih spojin, ki posledično vpliva na ravnotežje.
Spreminjanje koncentracije reaktantov
Če v reakcijsko mešanico dodajamo reaktante, se reakcija prevesi v prid nastanka produktov. Če odstranimo reaktante, se ravnotežje prevesi v prid nastanka reaktantov.
Primer
Primer je brezplačno dostopen prijavljenim uporabnikom.
Prijavi se za brezplačen dostop do primera »
Za brezplačen dostop do primera je potrebno izpolniti svoj profil.
Popolni svoj profil »
Primer
Primer je brezplačno dostopen prijavljenim uporabnikom.
Prijavi se za brezplačen dostop do primera »
Za brezplačen dostop do primera je potrebno izpolniti svoj profil.
Popolni svoj profil »
Spreminjanje koncentracije produktov
Če v reakcijsko mešanico dodajamo produkte, se reakcija prevesi v prid nastanka reaktantov. Če odstranimo enega izmed produktov, se ravnotežje prevesi v prid nastanka produktov.
Primer
Primer je brezplačno dostopen prijavljenim uporabnikom.
Prijavi se za brezplačen dostop do primera »
Za brezplačen dostop do primera je potrebno izpolniti svoj profil.
Popolni svoj profil »
Primer
Primer je brezplačno dostopen prijavljenim uporabnikom.
Prijavi se za brezplačen dostop do primera »
Za brezplačen dostop do primera je potrebno izpolniti svoj profil.
Popolni svoj profil »


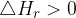 ) je potrebno dovajanje energije, zato da se tvorijo produkti. Torej pri dvigu temperature premaknemo ravnotežje v smer tvorbe produktov. Ravno nasprotno je pri eksotermnih reakcijah. Ker se pri eksotermnih reakcijah energija sprošča (
) je potrebno dovajanje energije, zato da se tvorijo produkti. Torej pri dvigu temperature premaknemo ravnotežje v smer tvorbe produktov. Ravno nasprotno je pri eksotermnih reakcijah. Ker se pri eksotermnih reakcijah energija sprošča (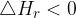 ), dovajanje dodatne energije preusmeri reakcijo v smer nastajanja reaktantov.
), dovajanje dodatne energije preusmeri reakcijo v smer nastajanja reaktantov.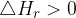 ) je potrebno dovajanje energije, zato da se tvorijo produkti. Torej pri znižanju temperature premaknemo ravnotežje v smer tvorbe reaktantov. Pri pri eksotermnih reakcijah se energija sprošča (
) je potrebno dovajanje energije, zato da se tvorijo produkti. Torej pri znižanju temperature premaknemo ravnotežje v smer tvorbe reaktantov. Pri pri eksotermnih reakcijah se energija sprošča (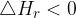 ), znižanje temperature preusmeri reakcijo v smer nastajanja produktov.
), znižanje temperature preusmeri reakcijo v smer nastajanja produktov.