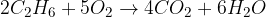Osebne zbirke


Kemijska reakcija je proces, pri katerem pride do trajne spremembe kemijskih in fizikalnih lastnosti spojin. S ciljem, da bi kemijske reakcije zapisali na kar najbolj nazoren način, reakcije zapišemo s pomočjo kemijskih enačb. Kemijske enačbe so shematski prikaz kemijskih reakcij.
Kemijska enačba je sestavljena iz:
levega dela, kjer so navedeni reaktanti,
desnega dela, kjer so navedeni produkti,
in puščice, ki nakazuje smer reakcije in pa morebitne reakcijske pogoje:
Shematski prikaz kemijske enačbe:

Na gornji shemi so:
reakcijski pogoji pogoji, pod katerimi se reakcija izvede. Reakcijski pogoji so lahko različni:
reakcijam dodamo katalizator,
reakcijo izvedemo pri določeni temperaturi,
reakcijam spremenimo pH,
idr.
Ob reaktante in produkte lahko navedemo tudi agregatno stanje. Agregatna stanja delimo na:
tekoče, ki ga označimo s črko l (liquid),
trdno, ki ga označimo s črko s (solid),
plinasto, ki ga označimo s črko g (gas),
raztopjleno v vodi, ki ga označimo s črko aq (aqueous).
Pri zapisu kemijskih enačb moramo vedno pazit, da so le-te urejene. To, da je kemijska enačba urejena, pomeni, da ima enačba na obeh straneh enako število atomov istih elementov. Pri tem upoštevamo dva zakona:
Zakon o ohranitvi mase,
Zakon o večkratnih razmerjih.
Zakon o ohranitvi mase pravi, da je vsota mas snovi, ki vstopajo v kemijsko reakcijo enaka vsoti mas snovi, ki pri reakciji nastanejo. To lahko povemo še drugače:
količina vsakega posameznega elementa se ne spremeni tekom procesa;
masa se ohranja oziroma masa ne more nastati iz nič ali pa v nič izginiti.
Proustov zakon o stalnih razmerjih se glasi: masno razmerje elementov v isti spojini je vedno enako.
Cilj postopka urejanja kemijskih enačb je, da:
iz enačbe, kjer na levi in desni strani reakcije ni enakega števila istih elementov, dobimo
enačbo, kjer je število istih elementov na obeh straneh enačbe enako.
Urejanja kemijskih enačb se lotimo tako, da preverimo, ali smo pravilno zapisali spojine. Nato sledimo nalednjim pravilom v danem vrstnem redu:
najprej uredimo kovine,
nato urejamo nekovine,
sledi urejanje vodikov,
na koncu pregledamo še kisike.
Kemijskih reakcij je veliko a nekateri produkti so tipični za določene reagente. Poznavanje le-teh nam lahko olajša proces določanja kemijskih reakcij. Poglejmo si nekaj primerov reakcij, ki so nam lahko v pomoč:
kislina + baza = sol + voda
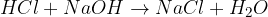
kislina + amonijak = amonijeva sol
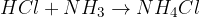
kislina + kovinski oksid = sol + voda
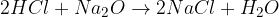
kislina + kovina = sol + vodik
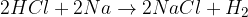
kovina + voda = baza + vodik
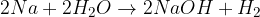
kovinski oksid + voda = baza
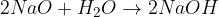
kovinski hidrid + voda = baza + vodik
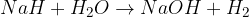
nekovinski oksid + voda = kislina
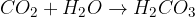
organska spojina + kisik = oglijkov dioksid + voda