Osebne zbirke


Baze so prisotne v mnogih vsakdanjih snoveh, kot so čistilna sredstva, in gospodinjskih izdelkih, kot so mila in detergenti. Prepoznamo jih po njihovem grenkem okusu ali sluzasti teksturi. Poglejmo, kako so baze opredeljene z vidika kemije.
Baze so snovi, ki v vodni raztopini tvorijo hidroksidne ione 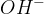 . Ko govorimo o bazah, običajno mislimo na vodne raztopine baz.
. Ko govorimo o bazah, običajno mislimo na vodne raztopine baz.
Med baze uvrščamo:
kovinske hidrokside - spojine, ki vsebujejo ione kovine in hidroksidne ione 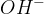 , ter
, ter
amonijak 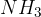 .
.
Kovinski hidroksidi imajo že v svoji formuli hidroksidne ione 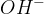 . Amonijak pa hidroksidne ione tvori šele ob stiku z vodo. Kovinski hidroksidi v trdnem stanju ne vsebujejo prostih hidroksidnih ionov, ampak so ti povezani s kovinskimi ioni. Trda baza nima bazičnih lastnosti dokler ne pride v stik z vodo ali vlago in razpade na kovinske in hidorksine ione.
. Amonijak pa hidroksidne ione tvori šele ob stiku z vodo. Kovinski hidroksidi v trdnem stanju ne vsebujejo prostih hidroksidnih ionov, ampak so ti povezani s kovinskimi ioni. Trda baza nima bazičnih lastnosti dokler ne pride v stik z vodo ali vlago in razpade na kovinske in hidorksine ione.
Hidroksidni ioni 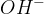 dajejo raztopinam kovinskih hidroksidov in raztopini amonijaka bazične lastnosti:
dajejo raztopinam kovinskih hidroksidov in raztopini amonijaka bazične lastnosti:
grenak okus,
pH raztopine je večji od 7,
Pogledali si bomo zapisovanje formul baz, ki spadajo med kovinske hidrokside. Kovinski hidroksid vsebuje:
ion kovine in
hidroksidni ion 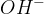 .
.
V formuli najprej navedemo ion kovine, nato pa hidroksidni ion.
Ion kovine ima vedno pozitiven naboj, hidroksidni ion pa ima vedno negativen naboj 1-.
Kolikšna je številčna vrednost pozitivnega naboja kovinskega iona, pa je odvisno od tega, koliko elektronov mora atom kovine oddati hidroksidnemu ionu, da se iz kovine tvori kovinski ion.
Poglejmo, kakšen bo naboj ionov kovine:
elementi I. skupine oddajo 1 elektron in ioni I. skupine imajo zato naboj 1+,
elementi II. skupine oddajo 2 elektrona in ioni II. skupine imajo zato naboj 2+,
elementi III. skupine oddajo 3 elektrone in ioni III. skupine imajo zato naboj 3+.
Spojine so navzven nevtralne, zato imajo kovinski hidroksidi v formuli različno število hidroksidnih ionov.
Hidroksidni ion obravnavamo kot eno samostojno enoto in ne kot spoj dveh enot (dveh elementov).
Če je število hidroksidnih ionov večje od 1, damo celoten hidroksidni ion v oklepaj, za oklepajem pa navedemo število hidroksidnih ionov.
Pogledali si bomo poimenovanje baz, ki spadajo med kovinske hidrokside in so sestavljene iz kovinskega iona oziroma kationa in hidroksidnega iona. Pri poimenovanju kovinskih hidroksidov se držimo korakov:
Zapišemo ime kovine s slovensko osnovo,
Dodamo končnico -ev ali -ov,
Naredimo presledek in dodamo ime hidroksidnega iona - hidroksid.
Najprej si bomo pogledali nastanek baz kovinskih hidroksidov, nato pa še nastanek amonijaka.
Baze nastanejo, ko kovinski oksidi reagirajo z vodo.
Baza amonijak nastane pri raztapljanju plina amonijaka v vodi.
Baze nastanejo pri reakciji kovinskih oksidov z vodo:
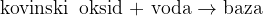
Vodna raztopina baze amonijaka nastane pri raztapljanju plina amonijaka v vodi:
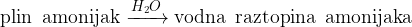
Za vodne raztopine baz so značilni hidroksidni ioni. Že v uvodu smo zapisali, da kovinski hidroksidi v vodi razpadejo na hidroksidne ione, amonijak pa hidroksidne ione tvori ob stiku z vodo.
Hidroksidni ion je sestavljen iz kisika in vodika in ima negativen naboj. Zapišemo ga s formulo:
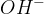
Poglejmo si še kroglični in kalotni model hidroksidnega iona:
Najprej si poglejmo razpad kovinskega hidroksida v vodi. Splošna enačba razpada kovinskega hidroksida, ki se zgodi v vodi je sledeča:
Oznake v splošni enačbi so:
formula 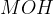 predstavlja kovinskih hidroksid -
predstavlja kovinskih hidroksid - 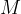 je kovina,
je kovina, 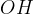 pa hidroksidni ion,
pa hidroksidni ion,
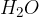 je molekula vode,
je molekula vode,
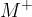 predstavlja ion kovine s pozitivnim nabojem in
predstavlja ion kovine s pozitivnim nabojem in
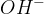 predstavlja hidroksidni ion.
predstavlja hidroksidni ion.
Nekoliko drugače hidroksidne ione tvori molekula amonijaka, ki hidroksidne ione tvori ob stiku z vodo tako, da vodi odvzame proton.
Baze so lahko šibke ali močne. Moč baze je odvisna od tega, koliko hidroksidnih ionov je prisotnih v raztopini baze.
Pri močni bazi v raztopini velika večina molekul baze razpade na kovinske ione in hidroksidne ione. Tako nastane veliko hidroksidnih ionov in kovinskih ionov oziroma baznih preostankov. V raztopini je zato prisotno le malo molekul baze.
Pri šibki bazi pa v raztopini le del molekul baze razpade na kovinske ione in hidroksidne ione. Tako nastane malo hidroksidnih ionov in kovinskih ionov oziroma baznih preostankov. V raztopini je zato prisotno veliko število molekul baze.
Spodnja tabela prikazuje primerjavo med močno in šibko bazo glede na število molekul baze, število hidroksidnih ionov in število baznih preostankov v raztopini.
Med močne baze uvrščamo baze na spodnjem seznamu. Baze so urejene po vrsti - najmočnejša baza je navedena na vrhu, potem pa moč baze pada po vrsti navzdol:
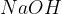
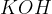
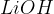
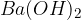
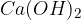
Med šibke baze pa uvrščamo baze na spodnjem seznamu. Baze so urejene po vrsti - najšibkejša baza je navedena na dnu seznama:
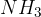
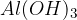
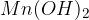
Baze so v vsakdanjem življenju manj v uporabi, kot kisline. Še vedno pa so baze prisotne v pomembnih in uporabnih snoveh. Pogledali si bomo nekaj primerov.
Natrijev hidroksid 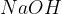 pogosto uporabljamo za čiščenje odtokov. Ker je zelo močna baza, lahko učinkovito razgrajuje maščobe in druge snovi, ki se nakopičijo v ceveh.
pogosto uporabljamo za čiščenje odtokov. Ker je zelo močna baza, lahko učinkovito razgrajuje maščobe in druge snovi, ki se nakopičijo v ceveh.
Amonijak 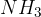 se nahaja v čistilih za steklo. Je šibka baza, vendar vseeno odstranjuje nekatere madeže in umazanijo na steklih.
se nahaja v čistilih za steklo. Je šibka baza, vendar vseeno odstranjuje nekatere madeže in umazanijo na steklih.
Kalcijev hidroksid 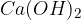 imenujemo tudi gašeno apno in ga uporabljamo v gradbeništvu za izdelavo mavca, malte in drugih gradbenih materialov.
imenujemo tudi gašeno apno in ga uporabljamo v gradbeništvu za izdelavo mavca, malte in drugih gradbenih materialov.
Kalijev hidroksid 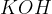 je pomembna sestavina za proizvodnjo tekočega mila.
je pomembna sestavina za proizvodnjo tekočega mila.
Kadar delamo z bazami je pomembno, da smo previdni. Trdne baze so jedke in nevarne, saj lahko hitro reagirajo z vlago iz kože ali zraka in povzročijo poškodbe. Prav tako so jedke tudi koncentrirane baze. Oboje lahko povzročijo poškodbe kože, oči ali dihalnih poti.
Pri delu s trdnimi bazami in z raztopinami baz moramo vedno nositi zaščitno opremo, kot so rokavice in očala.
Zaradi možnosti vdihavanja trdnih delcev baz je pomembno, da z bazami delamo v prostoru, ki nudi dobro prezračevanje.
Previdni moramo biti tudi pri pripravi raztopine baze, ki jo pripravimo iz trdne baze in vode.
Ko pripravljamo raztopine baze iz trdne baze in vode, vedno počasi dajemo trdno bazo v vodo.
Vode nikoli ne zlivamo na trdno bazo, saj bi lahko prišlo do brizganja raztopine baze zaradi energije, ki se sprosti, ko trdna baza reagira z vodo.
V primeru stika z bazo moramo prizadeto mesto temeljito izpirati z veliko količino vode ter poiskati zdravniško pomoč.