Osebne zbirke


Kisline so prisotne v kisu, pogosto jih najdemo tudi v sadju in zelenjavi. Prepoznamo jih po njihovem kislem okusu. Poglejmo, kako so kisline opredeljene z vidika kemije.
Kisline so snovi, ki vsebujejo vodikove protone 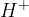 in atome nekovin. Ko govorimo o kislinah, običajno mislimo na vodne raztopine kislin.
in atome nekovin. Ko govorimo o kislinah, običajno mislimo na vodne raztopine kislin.
Če molekula kisline pride v stik z vodo, pride do kemijske reakcije, kjer kislina vodi odda svoje protone. Kislina rada odda vodikov proton vodi, ker s tem kislina doseže bolj stabilno stanje. Iz vode nastanejo oksonijevi ioni 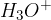 , od kisline pa ostane kislinski preostanek.
, od kisline pa ostane kislinski preostanek.
Oksonijevi ioni 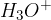 dajejo vodni raztopini kisle lastnosti:
dajejo vodni raztopini kisle lastnosti:
kisel okus,
pH raztopine je manjši od 7,
Oksonijevi ioni nastanejo le ob prisotnosti vode. Brez vode kisline ne proizvajajo oksonijevi ionov in zato ne kažejo kislih lastnosti.
Najprej si poglejmo tri skupine kislin. Kisline uvrščamo v skupine glede na njihovo kemijsko sestavo. Skupine kislin so:
binarne kisline,
oksokisline in
organske karboksilne kisline.
Binarne kisline vsebujejo dva elementa: vodik in značilno nekovino. Splošna formula za binarno kislino je:
V splošni formuli so:
H je simbol za vodik,
x (označeno z rdečo) predstavlja število vodikovih atomov,
A (označeno z modro) pa predstavlja nekovino.
Oksokisline so kisline, ki poleg vodika in značilne nekovine vsebujejo še kisik. Splošna formula za oksokisline je:
V splošni formuli so:
H je simbol za vodik,
x (označeno z rdečo) predstavlja število vodikovih atomov,
A (označeno z modro) predstavlja nekovino;
O (označeno z zeleno) je simbol za kisik;
y (označeno z oranžno) predstavlja število kisikovih atomov.
Organske karboksilne kisline so kisline, sestavljene iz ogljika in vodika ter značilne karboksilne skupine  .
.
Kisline poimenujemo različno glede na to, v katero skupino (binarne kisline, oksokisline, karboksilne kisline) uvrščamo kislino.
Tukaj si poglejmo poimenovanje binarnih kislin in oksokislin. Poimenovanje karboksilnih kislin pa je opisano v gradivu Karboksilne kisline.
Binarne kisline vsebujejo vodik in nekovino. Pri poimenovanju binarnih kislin sledimo korakom:
zapišemo ime nekovine
dodamo končnico -o-
brez presledka zapišemo ime vodika
dodamo končnico -ova (v primeru centralne nekovine fosforja dodamo končnico -jeva)
naredimo presledek in dodamo besedo kislina
Oksokisline vsebujejo vodik, kisik in nekovino. Pri poimenovanju oksokislin sledimo korakom:
zapišemo ime centralne oziroma sredinske nekovine
dodamo končnico -ova (izjema je fosfor, kjer dodamo končnico -jeva)
naredimo presledek in dodamo besedo kislina
Pogledali si bomo nastanek:
binarnih kislin in
oksokislin.
Binarne kisline nastanejo pri raztapljanju vodikovih halogenidov ali vodikovega sulfida  v vodi.
v vodi.
Vodikovi halogenidi so spojine, ki so sestavljene iz vodika in halogenega elementa (vodikov fluorid, vodikov klorid, vodikov bromid...).
Najprej mora poteči reakcija nastanka vodikovega halogenida, nato pa še raztapljanje vodikovega halogenida v vodi.
Oksokisline nastanejo z raztapljanjem nekovinskih oksidov v vodi.
Nekovinski oksidi so spojine iz nekovine in kisika.
Najprej mora poteči reakcija nastanka nekovinskega oksida, nato pa še reakcija nekovinskega oksida z vodo.
Že v uvodu smo zapisali, da pri stiku molekule kisline z vodo pride do reakcije, kjer kislina vodi odda svoje protone. Protoni so delci, ki imajo pozitivni naboj 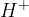 .
.
Molekula voda sprejme proton od kisline in s tem dobi pozitiven naboj. Število vodikov se poveča iz 2 na 3. Delec, ki nastane, imenujemo oksonijev ion in ga zapišemo:
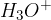
Poglejmo si še kroglični in kalotni model oksonijevega iona:
Kislina odda proton s pozitivnim nabojem. Ker izgubi pozitivni naboj, ima sedaj negativen naboj. Delec, ki nastane iz kisline imenujemo kislinski preostanek.
Poglejmo si še splošno enačbo reakcije molekule kisline z vodo:
Oznake v splošni enačbi so:
Molekulska formula 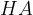 predstavlja molekulo kisline. Pri tem je
predstavlja molekulo kisline. Pri tem je  oznaka za vodik - proton,
oznaka za vodik - proton, 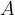 pa predstavlja preostali del kisline (atom nekovine oziroma atom kisika in atom nekovine).
pa predstavlja preostali del kisline (atom nekovine oziroma atom kisika in atom nekovine).
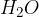 je molekula vode,
je molekula vode,
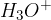 oksonijev ion in
oksonijev ion in
 predstavlja kislinski preostanek.
predstavlja kislinski preostanek.
Nekatere kisline vsebujejo več vodikovih atomov - protonov. Te kisline vodi oddajo vse svoje protone:
Če ima kislina 2 protona, bo en proton dala eni molekuli vode, drug proton pa drugi molekuli vode. Tako bosta nastala 2 oksonijeva iona.
Če ima kislina 3 protone, bodo nastali 3 oksonijevi ioni, in tako naprej.
Če kislina odda več protonov, ni nujno, da je kislina tudi močnejša, kar bomo videli v naslednjem poglavju.
Poseben primer so organske karboksilne kisline, ki vsebujejo funkcionalno skupino  .
.
Organske kisline imajo poleg funkcionalne skupine še atome ogljika in vodika. Vendar pa lahko karboksilne kisline oddajo le vodik iz funkcionalne skupine  .
.
Ostalih vodikov karboksilne kisline ne morejo oddati. Proton v funkcionalni skupini karboksilne kisline je vezan najšibkeje in voda lahko iztrga ta proton iz kisline. Ostali vodikovi atomi v karboksilni kislini so bolj trdno vezani in jih kislina ne more oddati molekuli vode.
Pri reakcijah vseh kislin z vodo nastanejo kislinski preostanki. Ti imajo negativen naboj, zato jih uvrščamo med negativne ione oziroma anione.
Kislinske preostanke poimenujemo po naslednjih korakih:
zapišemo latinsko ime nekovine,
dodamo končnico -idni ion v primeru binarne kisline ali pa končnico -atni ion v primeru oksokisline
V tabeli so zbrane kisline, ki smo jih spoznali ter njihovi kislinski preostanki in poimenovanja kislinskih preostankov:
Kisline so lahko šibke ali močne. Moč kisline je pomembna, ker močnejše kisline lahko uporabimo za hitrejšo reakcijo z bazami. Z močnejšimi kislinami si lahko pomagamo tudi pri čiščenju ali odstranjevanju trdovratnih madežev. Poleg tega lahko močnejše kisline povečajo hitrost nekaterih kemijskih reakcij.
Moč kisline je odvisna od tega, koliko oksonijevih ionov je prisotnih v raztopini kisline.
Pri močni kislini v raztopini velika večina molekul kisline odda svoje protone vodi in tako nastane veliko oksonijevih ionov in kislinskih ostankov. V raztopini je zato prisotno le malo molekul kisline.
Pri šibki kislini pa v raztopini le del molekul kisline odda svoje protone vodi in tako nastane malo oksonijevih ionov in kislinskih ostankov. V raztopini je zato prisotno veliko število molekul kisline.
Spodnja tabela prikazuje primerjavo med močno in šibko kislino. Zapisana je količina molekul kisline, oksonijevih ionov in kislinskih ostankov v raztopini.
Med močne kisline uvrščamo kisline na spodnjem seznamu. Kisline so urejene po vrsti - najmočnejša kislina je navedena na vrhu, potem pa moč kisline pada po vrsti navzdol:
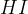

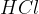
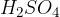
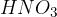
Med šibke kisline pa uvrščamo kisline na spodnjem seznamu. Kisline so urejene po vrsti - najšibkejša kislina je navedena na dnu seznama:


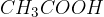



Kisline spadajo med pomembne spojine, ki jih vsakodnevno uporabljamo ali se z njimi srečujemo. Pogledali si bomo nekaj primerov.
Žveplova kislina 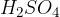 je jedka in higroskopna, kar pomeni, da nase veže vodo. Vodo lahko veže predvsem iz organskih snovi na primer iz lesa, sladkorja in papirja. Uporabljamo jo v proizvodnji gnojil, barv in čistilnih sredstev, prisotna pa je tudi v akumulatorju.
je jedka in higroskopna, kar pomeni, da nase veže vodo. Vodo lahko veže predvsem iz organskih snovi na primer iz lesa, sladkorja in papirja. Uporabljamo jo v proizvodnji gnojil, barv in čistilnih sredstev, prisotna pa je tudi v akumulatorju.
Kadar žveplovo kislino redčimo z vodo, moramo vedno vlivati kislino v vodo in ne obratno. Pri mešanju kisline z vodo se namreč sprosti veliko toplote in raztopina se zato močno segreje.
Fosforjevo kislino  uporabljamo v proizvodnji umetnih gnojil in v kozmetični industriji. Pomembna je tudi v prehrambeni industriji, kjer jo uporabljamo za uravnavanje kislosti v gaziranih pijačah in nekaterih drugih živilih.
uporabljamo v proizvodnji umetnih gnojil in v kozmetični industriji. Pomembna je tudi v prehrambeni industriji, kjer jo uporabljamo za uravnavanje kislosti v gaziranih pijačah in nekaterih drugih živilih.
Etanojsko ali ocetno kislino 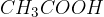 uporabljamo v čistilih, kot je čistilo za steklo. Najdemo jo tudi v kuhinji kot del običajnega kisa, kjer se nahaja 4-5 % ocetne kisline.
uporabljamo v čistilih, kot je čistilo za steklo. Najdemo jo tudi v kuhinji kot del običajnega kisa, kjer se nahaja 4-5 % ocetne kisline.
Klorovodikova kislina 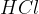 je naravno prisotna v želodčnem soku v našem želodcu in je pomembna za prebavni proces. Klorovodikova kislina sodeluje pri razgradnji hrane in aktivira encime, ki razgrajujejo beljakovine. Pomaga tudi pri ubijanju bakterij in drugih mikroorganizmov, ki vstopijo v prebavni sistem skozi hrano.
je naravno prisotna v želodčnem soku v našem želodcu in je pomembna za prebavni proces. Klorovodikova kislina sodeluje pri razgradnji hrane in aktivira encime, ki razgrajujejo beljakovine. Pomaga tudi pri ubijanju bakterij in drugih mikroorganizmov, ki vstopijo v prebavni sistem skozi hrano.
Pri delu s kislinami je zelo pomembna previdnost! Mnoge kisline imajo jedke lastnosti. To pomeni, da lahko povzročijo raztapljanje ali uničevanje trdne površine drugih materialov.
Še posebej so nevarne koncentrirane kisline, zato je pri delu z njimi potrebna izredna previdnost. Če kislina pride v stik s kožo ali očmi, povzroči opekline in poškodbe.
Pri delu s kislinami moramo vedno nositi zaščitno opremo, kot so rokavice in očala.
Previdni moramo biti tudi pri redčenju kislin.
V primeru stika s kislino moramo prizadeto mesto temeljito izpirati z veliko količino vode ter poiskati zdravniško pomoč.