Osebne zbirke


Organska reakcija poteče, kadar eden izmed reaktantov "napade" drugega. To se zgodi, če ima:
ena izmed molekul prebitek elektronov oziroma če je znotraj molekule elektronsko bogato mesto,
druga molekula primanjkljaj elektronov oziroma če je znotraj molekule elektronsko revno mesto.
Elektronsko bogata mesta so področja znotraj molekul, kjer so:
nenasičene (dvojne ali trojne) vezi,
negativno nabit ion.

Slika 1: Elektronsko bogata mesta na molekulah ogljikovodikov: A) dvojna vez, B) trojna vez C) delokalizirani elektroni v benzenovem obroču in njemu podobna območja.
Elektronsko deficitarna (revna) mesta pa so področja znotraj molekule, kjer imamo:
vezi med atomi z različno elektronegativnostjo. Opomba: elektronegativnost opredelimo kot sposobnost atoma, da privlači elektronski par.
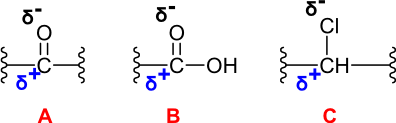
Slika 2: Elektronsko revno mesto je ogljik v usmerjenenih vezeh: A) ogljik v karbonilni skupini, B) ogljik v karboksilni skupini, C) ogljik, na katerega so vezani halogeni elementi.
V organski kemiji poznamo tri tipe delcev, ki lahko sprožijo reakcijo:
elektrofile,
nukleofile,
radikale.
Poglejmo si jih.
Elektrofil je delec, ki napade mesta bogata z elektroni (slika 1). Sam ima primanjkljaj elektronov, zato jih poišče na sosednji molekuli. Elektrofili so lahko:
pozitivno nabiti delci,
nevtralne molekule s pomanjkanjem elektronov (elektrondeficitarne molekule).
Pozitivno nabiti delci nastanejo pri heterolitski cepitvi kovalentne vezi, pri čemer:
en del molekule pobere oba elektrona iz vezi in postane negativno nabit;
drugi del - to je elektrofil - pa ostane brez elektrona in se zato pozitivno nabije.
Nevtralni elektrofili so navadno spojine aluminija (Al) in bora (B), ki imajo namesto običajnega okteta le šest elektronov in zato poskušajo dopolniti svoj oktet (glej gradivo Struktura molekul). Primeri nevtralnih elektroofilov so:
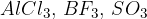
Reakcije, v katerih prvi napada elektrofil, imenujemo elektrofilne reakcije. Shema elektrofilne reakcije je prikazana na sliki 5, kjer elektrofil (označimo ga z  ) napade področje na molekuli, ki je bogato z elektroni - v tem primeru dvojno vez:
) napade področje na molekuli, ki je bogato z elektroni - v tem primeru dvojno vez:
Elektrofil napade dvojno vez in se veže na enega izmed ogljikov. Spojina, ki nastane, je samo vmesno stanje, ki ga imenujemo itermediat (označimo ga z oglatim oklepajem).
Nukleofil je delec, ki napade mesto na molekuli, ki je revna z elektroni. Sam ima prebitek elektronov, zato poišče tisto mesto, kjer so elektroni v primanjkljaju. Nukleofili so lahko:
negativno nabiti delci,
nevtralne molekule z neveznimi elektronskimi pari.
Negativno nabiti delci nastanejo pri heterolitski cepitvi kovalentne vezi. Delec, ki pobere oba elektrona iz vezi, se pretvori v anion, ki lahko napada ogljike s primanjkljajem elektronov. Ogljiki s primanjkljajem elektronov so pravzaprav atomi, kjer nastane pozitivni dipol.
Nevtralni nukleofili so spojine, ki vsebujejo atome dušika  , kislika
, kislika  .
.
Poglejmo si podrobneje strukturo enega izmed nevtralnih nukleofilov.
Reakcije, v katerih prvi napada nukleofil, imenujemo nukleofilne reakcije. Shema nukleofilne reakcije je prikazana na sliki 9, kjer nukleofil (označen z 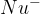 ) napade vez med ogljikom in klorom. Vez med ogljikom in vodikom je usmerjena vez, pri čemer na ogljiku nastane primanjkljaj elektronov.
) napade vez med ogljikom in klorom. Vez med ogljikom in vodikom je usmerjena vez, pri čemer na ogljiku nastane primanjkljaj elektronov.
Radikal je izredno reaktiven delec, ki ima nesparjen elektronski par. Radikali lahko napadejo tudi izredno močne  vezi med:
vezi med:
dvema ogljikoma,
med ogljikom in vodikom.
Radikali nastanejo pri homolitski cepitvi vezi, kar pomeni, da se molekula razcepi tako, da vsak izmed delov spojine pridobi po en elektron iz veznega elektronskega para:
Do homolitske cepitve pride pod vplivom UV-sevanja. Običajno pri radikalskih reakcijah označujemo prisotnost svetlobe:
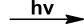
Slika 12: Slika prikazuje pogoj, da poteče radikalska reakcija. Oznaka hv pomeni ultravijolično svetlobo.
Nesparjen elektron označimo kot majhno "pikico" ob radikalskem delcu:
Reakcije, kjer nastopajo radikali, imenujemo radikalske reakcije. Shema radikalske reakcije je prikazana na sliki 14, kjer radikal iz alkana odcepi vodik in se veže na njegovo mesto: