Osebne zbirke


V gradivu Redoks spremembe smo spoznali pojma redukcija in oksidacija. To sta procesa, kjer elektroni prehajajo iz enega elementa na drugega. Elementom se pri tem procesu spreminja oksidacijsko stanje (oziroma oksidacijsko število). Pri teh pojavih igra pomembno vlogo redoks potencial posameznih elementov. Le-tega lahko ovrednotimo s pomočjo standardnega elektrodnega potenciala. Oba pojma in njihovo uporabnost bomo spoznali v tem poglavju.
Pravimo, da se element - s tem, ko sprejema elektrone - reducira. In redoks potencial je merilo, s katerim ovrednotimo sposobnost nekega elementa ali spojine, da privleče elektrone. Redoks potencial merimo v voltih (V).
Standardni elektrodni potencial 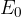 je redoks potencial posameznih elementov merjen pri standardnih pogojih (temperatura 25°C, tlak 1 atmosfera). Vrednosti standardnega elektrodnega potenciala za posamezne elemente (in spojine) so eksperimentalno izmerjeni in zapisani tabelo, ki ji pravimo elektrokemijska napetostna vrsta.
je redoks potencial posameznih elementov merjen pri standardnih pogojih (temperatura 25°C, tlak 1 atmosfera). Vrednosti standardnega elektrodnega potenciala za posamezne elemente (in spojine) so eksperimentalno izmerjeni in zapisani tabelo, ki ji pravimo elektrokemijska napetostna vrsta.
Posamezne elektrodne potenciale izmerimo glede na referenčni potencial, ki ga imenujemo standardna vodikova elektroda. V standardni vodikovi elektrodi (t.i. vodikov polčlen, glej gradivo Galvanski člen) poteka naslednja ravnotežna reakcija:
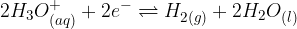
Pri tej reakciji se spreminja oksidacijsko število vodika iz +1 v 0 in obratno. Ker reakcija znotraj vodikove elektrode poteka v obe smeri, jo lahko uporabimo kot standard za vse preostale procese.
Reakcijo v vodikovem polčlenu lahko zapišemo tudi v poenostavljeni obliki:
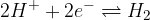
in po dogovoru je vrednost standardnega elektrodnega potenciala za to elektrodo:
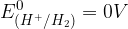
Standardne elektrodne potenciale posameznih elementov vedno zapišemo za redoks par. Poglejmo si, kaj so redoks pari.
Zapisu za oksidirano in reducirano obliko posameznega elementa pravimo redoks par. Za vsak tak zapis imamo tudi eksperimentalno izmerjeno reduktivno sposobnost (standardni elektrodni potencial).
Pri zapisu redoks parov za kovine vedno nastopata:
ionska oblika kovine in
elementarna oblika kovine.
Elementarna oblika kovine se pretvori v ionsko, če odda elektron (oksidira). Tako velja, da je:
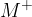 ,
,Iz teorije vemo, da se s sprejemanjem elektronov ioni reducirajo in (v večini primerov) nastanejo elementarne kovine. Torej s pomočjo pretakanja elektronov lahko pridobivamo različne oblike istega elementa. Poglejmo si primer take reakcije.
Standardni elektrodni potenciali niso omejeni samo na kovinske redoks pare. Tudi določene molekule lahko spreminjajo oksidativno stanje, zato jim lahko določimo potencial tako kot kovinam.
Pri redukciji nekovinskih delcev lahko opazimo, da le ti sprejemajo elektrone in prehajajo v anione. Ta sprememba je lepo vidna pri redukciji halogenih elementov.
Standardni redukcijski potenciali oziroma standardni elektrodni potenciali elementov so eksperimentalno izmerjeni in navedeni v spodnji tabeli. V tabeli so navedene reakcije v obliki redukcije, kar pomeni, da opazovani atom sprejema elektrone.
Elektrokemijska napetostna vrsta je urejena s pojemajočim standardnim elektrodnim potencialom. Velja, da nižje kot je element v tabeli, raje bo oddajal elektrone oziroma:
oksidacijska sposobnost elementov je z vsako vrstico manjša;
redukcijska sposobnost elementov je z vsako vrstico večja.
Kot primer lahko navedemo prvi in zadnji element v tabeli:
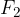 ima najvišji elektrodni potencial, zato je najmočnejši oksidant.
ima najvišji elektrodni potencial, zato je najmočnejši oksidant.
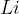 ima najnižji elektrodni potencial, zato je najmočnejši reducent.
ima najnižji elektrodni potencial, zato je najmočnejši reducent.
Tabela s standardnimi redukcijskimi potenciali pri temperaturi 25°C in tlaku 1 atmosfera:
Redoks par z nižjim redoks potencialom je boljši reducent. V praksi to pomeni, da če le ima možnost, odda elektrone iz zadnje lupine in preide v ionsko obliko.
A ni nujno, da določena reakcija sploh steče. Pri napovedovanju reakcij med posameznimi kovinami si pomagamo z uporabo redoks vrste za kovine:
Velja:
bolj levo v vrsti kot je element, boljši reducent je (oddaja elektrone in preide v ionsko obliko);
bolj desno v vrsti kot je element, boljši oksidant je (raje sprejema elektrone in preide v elementarno obliko).
Če hočemo izvedeti ali nekaj reakcija poteče, enostavno primerjamo položaje elementov znotraj redoks vrste in pogledamo njihovo stanje (oksidirano / reducirano).
Če za primer vzamemo Litij 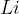 , opazimo, da leži skrajno levo v naši redoks vrsti, kar pomeni, da je sposoben reducirat vse druge elemente.
, opazimo, da leži skrajno levo v naši redoks vrsti, kar pomeni, da je sposoben reducirat vse druge elemente.
Vzemimo za primer 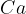 : kalcij lahko odda svoje elektrone tistim elementom, ki so v redoks vrsti na njegovi desni. Medtem ko elementi levo od kalcija, ne sprejemajo njegovih elektronov, ker je elektronegativnost kalcija višja (ima višji elektrodni potencial).
: kalcij lahko odda svoje elektrone tistim elementom, ki so v redoks vrsti na njegovi desni. Medtem ko elementi levo od kalcija, ne sprejemajo njegovih elektronov, ker je elektronegativnost kalcija višja (ima višji elektrodni potencial).
Tudi za halogene elemente lahko s pomočjo redoks vrste napovedujemo, ali bo neka reakcija potekla ali ne. Npr. fluor je najbolj elektronegativni element in s tem tudi najboljši oksidant. Fluor bo v raztopini vedno privlačil elektrone nase in se bo zato reduciral v ionsko obliko.
Elektronegativnost halogenih elementov po skupini periodnega sistema pada in z njim tudi standardni elektrodni potencial.
Standardni elektrodni potencial halogenih elementov po skupini periodnega sistema pada.
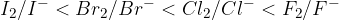
Fluor, ki je skrajno desno v naši elektronapetostni vrsti, je najmočnejši oksidant med halogenimi elementi. Medtem, ko iodovi ioni so najboljši reducenti med halogenimi elementi.
Tisti halogen, ki je višje postavljen v skupini periodnega sistema, bo oksidiral vse halogene pod njim. Višji kot je halogen v skupini bolj je elektronegativen (torej raje privlači elektrone nase) oziroma ima višji elektrodni potencial.