Osebne zbirke


V gradivu Entalpija smo spoznali, da energetskim spremembam tekom kemijskih reakciji sledimo s pomočjo tvorbene ali reakcijske entalpije. Če pa želimo izračunati celotno energijo, ki se porabi ali sprosti med kemijsko reakcijo, pa moramo upoštevati tudi količino snovi, ki v reakciji nastane.
Celotno toploto, ki se porabi ali sprosti med tvorbo produktov, izračunamo z enačbo:
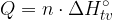
Celotno toploto, ki se sprosti ali porabi v kemijski reakciji, pa izračunamo z enačbo:
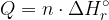
V obeh primerih je energija sorazmerna množini snovi, ki nastane.
Pri računanju toplote iz reakcijske entalpije moramo biti pazljivejši. Standardna reakcijska entalpija je podana v "kJ", za potrebe izračunov pa jo normaliziramo na mol - kar pomeni, da standardno reakcijsko entalpijo najprej preračunamo na en mol snovi (s tem dobi enoto 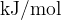 ) in šele nato izvedemo preostale račune.
) in šele nato izvedemo preostale račune.
Pri tem moramo izhajati iz urejene kemijske enačbe in upoštevati stehiometrično razmerje snovi.
Poglejmo si primer toplote, ki jo izračunamo s pomočjo tvorbene entalpije.
Poglejmo primer, v katerem uporabimo enačbo za izračun toplote iz reakcijske entalpije. Pri tem bodimo pozorni, kako standardno reakcijsko entalpijo najprej preračunamo na mol snovi.