Osebne zbirke


Izotopi so atomi istega elementa, ki se med seboj razlikujejo v številu nevtronov. Posledično se med seboj razlikujejo v:
fizikalnih lastnostih.
Kot atomi istega elementa pa imajo vsi enako vrstno število.
Veliko elementov imajo svoje izotope, omenili pa bomo samo najbolj pogoste.
Vodik ima načeloma 7 različnih izotopov, vendar so v naravi obstojni le trije. To so:
Vodik: v naravi najpogosteje najdemo vodik (označimo ga s črko H), ki je sestavljen iz:
1 elektrona,
1 protona,
0 nevtronov.
Je najpogostejši izotop vodika v naravi. Najdemo ga v obliki stabilnega, brezbarvnega, nestrupenega in lahko vnetljivega plina brez okusa, ali kot vezanega v vodi in organskih spojinah.
Devterij: drugi izotop vodika je devterij (včasih ga označimo tudi s črko D). Devterij je sestavljen iz
1 elektrona,
1 protona,
1 nevtrona.
Na zemlji ga najdemo samo za vzorec kot plin 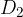 , ki ni reaktiven.
, ki ni reaktiven.
Tricij: tretji izotop vodika pa je tricij (označimo ga tudi s črko T). Devterij je sestavljen iz
1 elektrona,
1 protona,
2 nevtronov.
Zaradi dveh nevtronov je zelo nestabilen in rahlo reaktiven.
Zapišimo jih še v tabelo:
V tabeli lahko vidimo razmerje protonov, elektronov in nevtronov med tremi izotopi vodika. Zaradi različnega števila nevtronov, se razlikuje tudi masno število izotopov, kar pa bomo podrobneje razložili malo kasneje.
Za razliko od izotopov vodika, izotope ogljika ne poimenujemo. Poznamo 3 različne izotope:
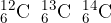
Podajmo jih v tabeli:
Tako kot pri izotopih vodika, v naravi najpogosteje najdemo izotop 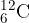 , izotopa
, izotopa 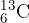 in
in 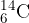 pa le za vzorec.
pa le za vzorec.
Uranove izotope uporabljamo kot energetski vir v jedrski tehniki. V naravi najpogosteje najdemo 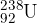 , izotopa
, izotopa 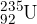 in
in 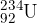 pa najdemo samo za vzorec.
pa najdemo samo za vzorec.
Relativno atomsko maso, ki jo najdemo zapisano v periodnem sistemu, predstavlja povprečje relativnih atomskih mas izotopov elementa in sicer pri izračunu upoštevamo delež posameznih izotopov v naravi.