Osebne zbirke


Periodni sistem predstavlja sistematično urejene lastnosti vseh do zdaj poznanih elementov. Nekatere fizikalne in kemijske lastnosti se lahko razvrsti glede na periodo (horizontalno po periodnem sistemu) oziroma na skupino (vertikalno po periodnem sistemu).
Običajno reprezentativne elemente (od I. do VIII. skupine, brez prehodnih elementov) obravnavamo po skupinah, saj imajo elementi v isti skupini podoben kemizem (podobne kemijske reakcije). A dva elementa obravnavamo posebej:
Vodik: kemizem vodika se precej razlikuje od drugih reprezentativnih elementov zato ga obravnavamo posebej, ločeno od drugih skupin.
Kisk: v anorganski kemiji se precej ubadamo z oksidi, oksokislinami in njihovimi solmi in zato posebej obravnavamo tudi kisik.
Vodikov atom ima najenostavnejšo strukturo med vsemi elementi (ima en elektron in en proton). Elementarni vodik se nahaja kot dvoatomna molekula povezana s nepolarnimi kovalentnimi vezmi.
Vez, ki povezuje atoma vodika je močna, zato je vodik obstojen pri sobni temperaturi. Ker ima nizko molsko maso, ima temu proprocionalno tudi nizko vrelišče, majhno gostoto, nizko topnost...
Poznamo tri vodikove izotope:
vodik (brez nevtrona)
devterij
tricij
Poglejmo si njihove lastnosti:
Vodik se lahko spaja skoraj z vsemi elementi. Pri tem lahko tvori tri različne tipe vezi:
Ionsko vez kot pozitivno nabit ion:
Če vodik odda svoj elektron, nastane pozitivno nabit 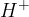 ion (imenujemo ga tudi proton, saj po oddaji elektrona, ostane samo proton). Je zelo reaktiven in ne obstaja samostojno. V vodi se spaja z molekulo vode in tvori t.i. oksonijev ion
ion (imenujemo ga tudi proton, saj po oddaji elektrona, ostane samo proton). Je zelo reaktiven in ne obstaja samostojno. V vodi se spaja z molekulo vode in tvori t.i. oksonijev ion 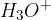 .
.
Ionsko vez kot negativno nabiti ion:
Če vodik sprejme elektron, nastane negativno nabiti 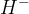 ion (imenujemo ga tudi hidridni ion). Hidride tvori z najbolj elektropozitivnimi elementi (Li, Na, K, Rb, Cs, Ca, Sr, Ba).
ion (imenujemo ga tudi hidridni ion). Hidride tvori z najbolj elektropozitivnimi elementi (Li, Na, K, Rb, Cs, Ca, Sr, Ba).
Večino vezi, ki jih tvori vodik, so kovalentne; pri tem lahko vodik tvori samo eno kovalentno vez. Če je vodik vezan na najbolj elektronegativne atome (F, O, N) tvori tako imenovano vodikovo vez. Vodikova vez je vez, ki nastane med molekulami, kjer se vodik veže na fluor, kisik ali dušik. Vodikova vez je posebna zato, ker vpliva na fizikalne lastnosti spojin kot je na primer vrelišče (molekule povezane z vodikovo vezjo imajo višje vrelišče od strukturno predvidene).
V tabeli imamo naštete fizikalne lastnosti elementarnega vodika:
Molekularni vodik je razmeroma nereaktiven. Navadno se vodik neposredno spaja z:
nekovinami (halogeni elementi, kisik, žveplo, fosfor)
kovinami (kot so alkalijske kovine in zemljoalkalijske kovine).
Vodik deluje kot reducent in se zato spaja tudi s kovinskimi oksidi.
Vodik sodi med najbolj razširjene elemente. Do 100km nad zemeljskim površjem je vodika (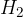 ) v atmosferi le za vzorec, v višinah nad 100km pa je atmosfera večinoma sestavljena iz vodika.
) v atmosferi le za vzorec, v višinah nad 100km pa je atmosfera večinoma sestavljena iz vodika.
Glavni vir za pridobivanje vodika je voda, najvažnejši postopek pridobivanja vodika pa katalitična reakcija med vodno paro in ogljikovodiki iz zemeljskega plina ter nafte. Postopek je sestavljen iz dveh korakov:
Metan + voda
V prvem koraku zmešamo plin metana in vodno paro:
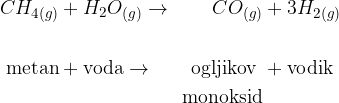
Dobimo ogljikov monoksid, ki ga ponovno zmešamo z vodno paro.
Ogljikov monoksid + voda
V drugem koraku zmešamo plin ogljikovega monoksida z vodno paro:
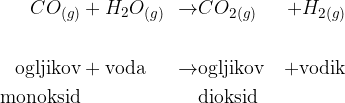
Ogljikov dioksid nato odstranimo iz zmesi, tako, da ga pod visokim tlakom raztopimo v vodi.
Drugi način za pridobivanje vodika, ki je razširjen v industriji, je elektroliza. Pri tem običajno uporabljajo nasičeno raztopino 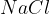 in živosrebrovo katodo:
in živosrebrovo katodo:
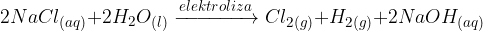
Vodik pa lahko pridobivamo tudi z drugimi postopki. Poglejmo si dva:
Reakcija vode s kovinami:
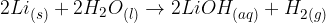
Lahko bi uporabili katerokoli drugo alkalno kovino.
Reakcija kislin s kovinami:
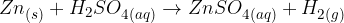
Kisik je izjemno razširjen element. Kisik je pomemben, ker omogoča življenje na zemlji, poleg tega je udeležen pri različnih spojinah (oksidi, oksokisline, soli...). Elementarna oblika kisika je dvoatomna molekula z dvojno kovalentno vezjo. Kisik običajno tvori dve vezi s sosednjimi atomi.
Kisikov atom ima poznane tri izotope:
Običajno je oksidativno stanje kisika -2. Tako oksidativno stanje ima kot oksid in v spojinah kot so oksokisline in njihove soli. Vendar pa se oksid lahko pojavlja tudi v drugih oksidativnih stanjih.
V tabeli imamo naštete fizikalne lastnosti elementarnega kisika:
Reakcije kisika z drugimi elementi so eksotermne. Elementi I. skupine periodnega sistema zelo burno reagirajo s kisikom. Pri tem nastajajo različni oksidi:
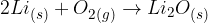
Lahko se tvorijo peroksidi:
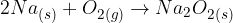
In celo superoksidi:
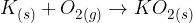
Kovinski oksidi nadalje reagirajo z vodo in tvorijo baze:
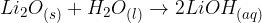
Kisik tvori različne okside tudi z nekovinami. Naštejmo nekatere izmed njih:
dušikovi oksidi: 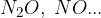
fosforjevi oksidi: 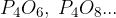
arzenovi, bizmutovi in anitmonovi oksidi: 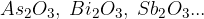
žveplovi oksidi: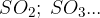
selenijevi, telurjevi, polonijevi oksidi: 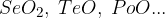
halogeni elementi: 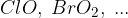 (z izjemo fluora, ki s kisikom ne reagira na tak način, saj je bolj elektronegativen od kisika.)
(z izjemo fluora, ki s kisikom ne reagira na tak način, saj je bolj elektronegativen od kisika.)
Kovinski oksidi reagirajo z vodo, pri čemer nastanejo kisline:
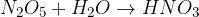
V nadaljevanju imamo prikazane nekatere tipične reakcije, ki nastanejo, če reagirajo posamezne kisikove zvrsti z vodo ali redčeno kislino:
Oksidi
pri reakciji z vodo nastane hidroksid
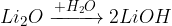
pri reakciji s kislino nastane sol in voda
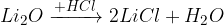
Peroksidi
pri reakciji z vodo nastane hidroksid in vodikov peroksid (ki pa je nestabilen in razpade)
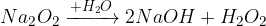
pri reakciji s kislino nastane sol in vodikov peroksid (nestabilen)
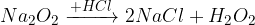
Superoksidi
pri reakciji z vodo nastane hidroksid, vodikov peroksid in kisik
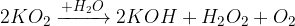
pri reakciji s kislino nastane sol, vodikov peroksid in kisik
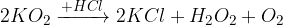
Ozon 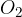 nastane, če molekulski kisik reagira z atomarnim kisikom. Le-ta lahko nastane:
nastane, če molekulski kisik reagira z atomarnim kisikom. Le-ta lahko nastane:
v ozračju pod vplivom UV-žarkov ali pa v električnem polju,
pri elektrolizi vodne raztopine žveplove (VI) kisline.
Lastnosti plinastega ozona so:
temno modra barva,
močan vonj,
vrelišče pri -110°C,
tališče pri -192°C,
v 1L vode ga lahko raztopimo 0,494L.
Je močnejši oksidant kot kisik in lahko reducira celo srebro do peroksida:
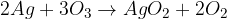
Voda je najpomembnejša in najbolj značilna spojina na Zemlji. V naravi ne najdemo čiste vode, ker ima vedno primešane še minerale. Površinska vodo, ki vsebuje raztopljene soli, običajno pojmujemo trda voda. Najbolj sta prisotna v vodi magnezijev in kalcijev hidrogenkarbonat.
Trdo vodo lahko očistimo soli z:
dodatkom kalcijevega hidroksida,
ionskimi izmenjevalci.
Merilo za čistost vode je njena prevodnost. Čista voda ima prevodnost približno 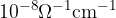 . Njena prevodnost je izredno majhna v primerjavi s prevodnostjo kovin (bakrova prevodnost je
. Njena prevodnost je izredno majhna v primerjavi s prevodnostjo kovin (bakrova prevodnost je 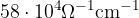 ).
).
Fizikalne lastnosti vode so neskladne glede na svojo strukturo. V primerjavi z molekulami s podobno strukturo (vodikov sulfid) ima voda ima glede na svojo sestavo:
visoko vrelišče,
visoko specifično toploto (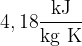 ),
),
kristalna oblika (led) ima nižjo gostoto od tekoče oblike (največja gostota je pri 4°C in znaša 1kg/L).
Tako voda kot vodikov sulfid imata kotno obliko, vendar pa sta njuni vrelišči precej narazen:
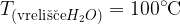
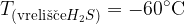
Razlike v fizikalnih lastnosti so posledica vodikovih vezi, ki so prisotne samo v vodi (ne pa tudi v vodikovem sulfidu).
Voda je odlično polarno topilo, v njej se raztapljajo predvsem ionski kristali in močno polarne molekule:
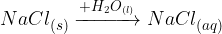
Voda je udeležena tudi pri vrsti oksidativnih procesov (reakcije z alkalnimi kovinami, drugimi molekulami).
Vodikov peroksid, 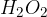 , nastane neposredno iz elementov. Njegova struktura ima nenavadno konformacijo. Zaradi steričnih ovir med posamezni atomi, se le-ti postavijo čim bolj narazen. Vendar pa že manjša razlika v kotih med H-O in O-O vezmi predstavlja veliko razliko v agregatnem stanju vodikovega peroksida:
, nastane neposredno iz elementov. Njegova struktura ima nenavadno konformacijo. Zaradi steričnih ovir med posamezni atomi, se le-ti postavijo čim bolj narazen. Vendar pa že manjša razlika v kotih med H-O in O-O vezmi predstavlja veliko razliko v agregatnem stanju vodikovega peroksida:
kot med vezmi je 94,8°  molekula je v plinastem agregatnem stanju;
molekula je v plinastem agregatnem stanju;
kot med vezmi 101,9°  molekula je v trdnem agregatnem stanju.
molekula je v trdnem agregatnem stanju.
Na sliki 4 je prikazana vmesna struktura med obema konformerama z vmesnim kotom:
V vodikovem peroksidu ima kisik oksidativno stanje -1, z razliko od običajnega oksidativnega stanje, ki je -2. Vodikov peroksid običajno razpade v stabilnejše oblike (vodo in kisik) in zaradi tega je močen oksidant.
V tekočem vodikovem peroksidu so molekule močno povezane med seboj zaradi vpliva vodikovih vezi, temu primerno ima tudi nekatere fizikalne lastnosti, ki odstopajo od strukturno predvidenih:
V tabeli lahko opazimo, da ima višje vrelišče in večjo gostoto od vode.
Vodikov peroksid je neobstojen in razpade na vodo in kisik.
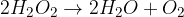
Razpad lahko inhibiramo (upočasnimo) s spojinami kot so:
fosforjeva (V) kislina,
natrijev difosfat (V),
organske kisline.
Zaradi tega razpada je vodikov peroksid močan oksidant:
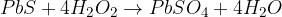
V reakciji z močnejšimi oksidanti deluje kot reducent: