Osebne zbirke


Privlačne sile med molekulami imenujemo molekulske vezi (tudi medmolekulske sile). Vse molekulske vezi imajo nekatere skupne značilnosti:
gre za električne privlačne sile med deli molekul z različno elektronsko gostoto;
so mnogo šibkejše od kemijskih vezi.
Glede na to, kaj se privlači v določenem primeru, razlikujemo naslednje vrste molekulskih vezi:
Van der Waalsova sila (vez)
Van der Waalsova sila (vez) temelji na privlačnih silah med električno nasprotnimi poli molekul. Razdelimo jih glede na nastanek in sicer na:
orientacijske,
indukcijske,
disperzijske.
Vodikova vez
Vodikova vez temelji na privlačni sili med:
elektropozitivnim vodikovim atomom, vezanim na atom dušika, kisika ali fluora in
neveznim elektronskim parom drugega atoma dušika, kisika ali fluora.
Poglejmo si oba tipa vezi podrobneje.
Van der Waalsove sile (vezi) so električne privlačne sile med nasprotnimi poli molekul (pozitivni pol ene molekule se z električno silo privlači z negativnim polom druge molekule).
O terminologiji: ker med seboj povezujejo molekule (v tekočinah in trdnih snoveh), jih imenujemo vezi; ker pa to niso takšne toge in močne povezave kot kemijske vezi, zanje raje uporabljamo izraz sile - ker gre pač le za privlačne sile med nasprotnimi poli. V nadaljnjem besedilu bomo uporabljali le še izraz sile.
Van der Waalsove sile so :
mnogo šibkejše od kemijskih vezi - tipične energije za njihovo pretrganje so med 1 in 5 kJ/mol;
neusmerjene.
Glede na način nastanka razlikujemo tri vrste Van der Waalsovih sil.
Orientacijske sile so privlačne sile med stalnimi dipoli polarnih molekul. Polarne molekule se v prostoru obrnejo - orientirajo - tako, da se približajo nasprotni poli, ker se med seboj privlačijo (glej sliko 1). Odtod ime "orientacijske sile".
Indukcijska sila nastane med polarno in nepolarno molekulo. Polarna molekula povzroči polarizacijo nepolarne molekule - rečemo, da inducira nastanek kratkotrajnega dipola (glej sliko 2), odtod ime "indukcijske sile". V tem primeru torej pride do privlačne sile med stalnim in kratkotrajnim dipolom.
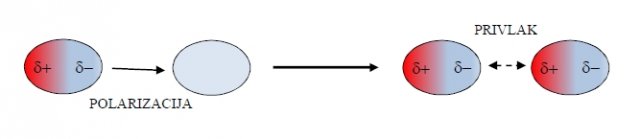
Slika 2: nepolarna molekule se v bližini polarne (levo) polarizira. Dobimo dve polarni molekuli, ki se privlačita (desno).
Disperzijske sile nastanejo med nepolarnimi molekulami in med atomi žlahtnih plinov. Zaradi naključnega gibanja elektronov, se nepolarna molekula lahko sama polarizira. Nastali kratkotrajni dipol vpliva na sosednje molekule na podoben način, kot je opisano pri indukcijskih silah.
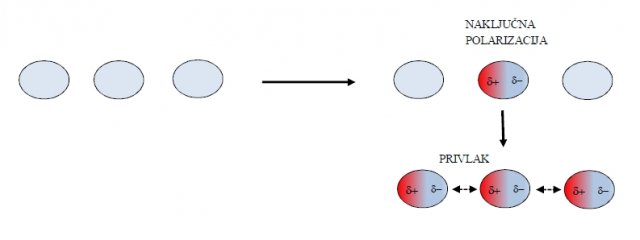
Slika 3: niz nepolarnih molekul (levo), se, zaradi slučajne polarizacije ene izmed molekul, polarizira (desno).
Poglejmo si podrobneje, kako lahko nepolarna molekula slučajno postane polarna.
Nepolarna molekula je pravzaprav le v povprečju nepolarna. To pomeni, da težišči pozitivnega in negativnega naboja v molekuli sovpadata v daljšem časovnem obdobju. To sovpadanje pa ne drži za kratke časovne intervale, ko so elektroni dejansko neenakomerno porazdeljeni. To pomeni, da je ena stran molekule vedno rahlo pozitivna, druga pa rahlo negativna. Rečemo lahko, da je nastal trenutni (kratkotrajni) dipol.
Takšni kratkotrajni dipoli vplivajo na sosednje molekule na podoben način, kot je opisano pri indukcijskih silah. Tako je v snovi, zgrajeni iz neke množine nepolarnih molekul, ves čas tudi mnogo privlačnih sil (enako velja za atome žlahtnih plinov).
Elektroni se znotraj molekule lahko premikajo tudi pod vplivom zunanjega električnega pola (polarne molekule) ali zunanjega naboja (iona). V teh primerih govorimo o nastanku indukcijske sile.
Disperzijske sile so najšibkejše med Van der Waalsovimi silami. So edina vrsta sil med nepolarnimi molekulami in atomi žlahtnih plinov, v resnici pa se te privlačne sile pojavljajo povsod, kjer je snov - delujejo tudi med atomi, ioni in polarnimi molekulami. Kadar se izračunava energije vezi med katerimikoli gradniki snovi, del te energije odpade na disperzijske sile.
Njihovo ime izvira iz podobnosti enačbe za izračun jakosti disperzijskih sil z enačbo za disperzijo (porazdeljevanje) delcev trdnega topljenca pri raztapljanju v tekočem topilu. Teh enačb v srednji šoli ne obravnavamo.
Vodikova vez je po svojih značilnostih znatno drugačna od Van der Waalsovih sil, zato jo tu obravnavamo ločeno. Za vodikove vezi velja:
so nekajkrat močnejše od Van der Waalsovih sil (a še vedno nekajkrat šibkejše od kemijskih vezi - tipične energije vodikovih vezi so okrog 20 kJ/mol);
so usmerjene.
Vodikova vez nastane, kadar se atom vodika, ki je vezan na močno elektronegativen atom, privlači z neveznim elektronskim parom drugega močno elektronegativnega atoma. Dovolj veliko elektronegativnost imajo atomi kisika, dušika in fluora.
Snovi, katerih molekule se povezujejo z vodikovimi vezmi (voda, amoniak, vodikov fluorid, alkoholi, karboksilne kisline ...), imajo višja tališča in vrelišča, kot druge snovi s primerljivo molekulsko maso. Zaradi vodikove vezi je voda tekoča pri običajnih temperaturah na Zemlji (snovi s podobno molekulsko maso so sicer plinaste).
Vodikova vez lahko vpliva tudi na nekatere druge fizikalne lastnosti (specifično toploto, talilno in izparilno entalpijo, viskoznost, ...)