Osebne zbirke


Snovi v plinastem agregatnem stanju se obnašajo drugače kot trdne snovi ali kapljevine. Medtem ko med gradniki trdnih snovi in kapljevin delujejo medmolekulske sile, ki jih držijo skupaj, so med plini te sile zanemarljivo majhne.
Plin si predstavljamo kot množico molekul, ki kaotično letijo po prostoru sem ter tja. Od robov prostora se odbijajo, prav tako pa trkajo tudi med seboj. S to predstavo lahko lažje razumemo lastnosti plinov:
Med molekulami vladajo velike razdalje.
Zaradi velikih razdalij, so medmolekulske vezi tako šibke, da jih v izračunih pogosto zanemarimo.
Ker so medmolekulske vezi šibke, se molekule plina prosto gibljejo.
Ker se molekule prosto gibljejo:
plini nimajo oblike: zavzamejo ves prostor, ki ga imajo na razpolago;
se plini med seboj zelo lahko mešajo;
je kinetična energija molekul višja kot pri kapljevinah in trdnih snoveh, kjer so molekule mnogo močneje vpete z medmolekulskimi vezmi.
V kemiji pri opisovanju plinskih sistemov uporabljamo slednje količine:
tlak,
volumen,
temperatura,
množina.
Vse te količine so združene v splošni plinski enačbi. Splošna plinska enačba je enačba, ki opisuje stanje idealnega plina. Idealni plin je približek realnih plinastih sistemov, pri čemer zanemarimo privlačne sile med molekulami plina in volumen, ki ga zavzamejo same molekule.
Plinska enačba je povezava med tlakom, volumnom in temperaturo plina s množino:
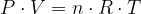
kjer je:
P tlak plina z enoto 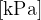
V volumen plina enoto 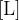
n množina plina z enoto 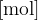
T temperatura plina z enoto 
R plinska konstanta z vrednostjo 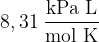
Čeprav plinska enačba opisuje dogajanje znotraj idealnega plina, jo lahko kot zelo dober približek uporabimo za večino drugih plinskih sistemov.
Plinska enačba je bila izpeljana iz plinskih zakonov (obravnavani nekoliko nižje). Slednji so izkustveno pridobljeni zakoni o obnašanju plina ob spreminjanju pogojev (tlaka, prostornine ali temperature), pri čemer eno izmed količin držimo konstantno.
Tlak, temperatura in volumen so med seboj odvisne količine. Te količine so povezane tudi prek treh plinskih zakonov. Plinski zakoni so izkustveno določene zveze med tlakom, prostornino in temperaturo plina:
Charlesov zakon (konstanten tlak)
Boylov zakon (konstantna temperatura)
Gay-Lussacov zakon (konstanten volumen)
Vsi trije zakoni, so bili kasneje sestavljeni v splošen plinski zakon. Poglejmo si te zakone podrobneje.
Obnašanje plina pri stalnem tlaku pomeni, da je:

Stanje, kjer je tlak konstanten imenujemo izobrano stanje.
Charlesov zakon je običajno obravnavan istočasno kot Guy-Lussacov (stalen volumen) in zasledimo v literaturi kar zapis Guy-Lussacovi zakoni (kjer se obravnavajo tako spremembe pri stalnem tlaku kot stalni prostornini).
Charlesov zakon pravi, da pri konstantni tlaku za idealni plin velja zveza:
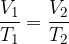
S pomočjo splošne plinske enačbe, dokažimo kako se obnašajo plini pod Charlesovim zakonom:
Obnašanje plina pri stalni temperaturi pomeni, da je:
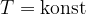
Stanje, kjer je temperatura konstantna imenujemo izotermno stanje.
Boylov zakon pravi, da pri konstantni temperaturi za idealni plin velja zveza:
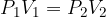
S pomočjo splošne plinske enačbe, dokažimo kako se obnašajo plini pod Boylovim zakonom:
Obnašanje plina pri stalnem volumnu pomeni, da je:
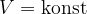
Stanje, kjer je prostornina konstantna imenujemo izhorno stanje.
Gay-Lussacov zakon pravi, da pri konstantni prostornini za idealni plin velja zveza:
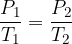
S pomočjo splošne plinske enačbe, dokažimo kako se obnašajo plini pod Gay-Lussacovim zakonom:
Za kemijske namene je pomembno kombinacija vseh treh zakonov. Velja, da kvocient med produktom tlaka in prostornine in temperaturo sistema ostane konstanten. Kombiniran plinski zakon je predhodnik splošne plinske enačbe.
Če razmerje med produktom tlaka in volumna ter temperature je konstanten, torej velja:
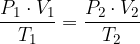
Sprememba enega dejavnika povzroči spremembo tudi preostalih dveh, zato da ohrani sistem konstanten.
Izpeljimo tale zakon.
Kombiniran plinski zakon pravi, da pri konstantni množini za idealni plin velja zveza:
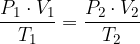
Izpeljimo zakon:
Poglejmo si na praktičnem primeru, kaj to pomeni.