Osebne zbirke


Protolitske reakcije so reakcije, ki prikazujejo obnašanje kislin in baz v vodi. V tem gradivu bomo obravnavali razpad kislin in baz v vodnih raztopinah. Kaj pa so kisline in baze?
Kisline in baze so določene na podlagi njihovega obnašanja v reakciji z vodo:
Kislina je snov, ki v stiku z vodo odda svoj proton 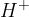 in tvori oksonijev ion
in tvori oksonijev ion 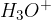 :
:
Baza je snov, ki v vodnih raztopinah sprošča hidroksidne ione 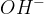 :
:
Kisline in baze pa lahko natančno definiramo brez uporabe vode, le s pomočjo prehoda protona:
kislina je snov, ki odda proton (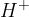 ion) bazi in obratno:
ion) bazi in obratno:
baza je tista snov, ki tak proton od kisline prejme.
Kislina je snov, ki odda proton (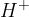 ion) bazi in baza je snov, ki tak proton od kisline prejme (Lowryeva definicija).
ion) bazi in baza je snov, ki tak proton od kisline prejme (Lowryeva definicija).
Poglejmo shematski prikaz kisline in baze. Bodimo pozorni na to, da se v tem primeru voda obnaša kot kislina:
Poglejmo si kisline in baze podrobneje.
Kisline med seboj ločimo po številu protonov, ki jih lahko oddajo:
Monoprotonske kisline
Monoprotonske kisline lahko bazi oddajo samo en proton.
Večprotonske kisline
Večprotonske kisline lahko bazi oddajo več protonov hkrati.
Kisline ločujemo lahko tudi po jakosti. Delimo jih na:
Močne kisline
Močne kisline so tiste snovi, ki v vodi takoj oddajo vse svoje protone in ostanejo v ionski obliki. Ko zapisujemo oddajanje protonov vodi, reakcijo zapišemo z enosmerno puščico:
Šibke kisline
Šibke kisline v vodi le delno razpadejo. Del molekul odda protone vodi, del molekul pa ostane nespremenjenih. Vzpostavi se ravnotežje. Reakcijo zapišemo z obojestransko puščico, ki nakazuje ravnotežno reakcijo:
Med baze uvrščamo:
vse kovinske hidrokside;
amonijak 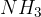 ;
;
Tudi baze ločujemo po jakosti:
Močne baze
Močne baze od vode prejmejo protone in ostanejo v ionski obliki. Ko zapisujemo reakcijo, le-to zapišemo z enosmerno puščico:
Šibke baze
Šibke baze v vodi le delno razpadejo. Del molekul prejme protone od vode, nekaj molekul pa ostane nespremenjenih. Vzpostavi se ravnotežje. Reakcijo zapišemo z obojestransko puščico, ki nakazuje ravnotežno reakcijo:
Protoliza je pojav, kjer kisline in baze v stiku z vodo razpadejo na ione. Pravimo, da kislina disociira na:
pozitivno nabite oksonijeve ione in
negativno nabite kislinske preostanke.
Enako velja za baze, kjer pride do disociacije na:
negativno nabite hidroksidne ione in
pozitivno nabite bazne preostanke.
Če si protolitsko reakcijo natančneje pogledamo, vidimo, da gre za reakcijo, kjer kislina odda proton bazi. Pri tem nastane konjugirani kislinsko-bazni par. Kislinsko-bazni par sta delca, ki se medsebojno razlikujeta po samo enem protonu.
Oglejmo si povedano na praktičnem primeru.
Konjugirana kislina nastane iz baze in se od nje razlikuje, ker ima en 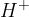 več.
več.
Konjugirana baza nastane iz kisline in se od nje razlikuje, ker ima en 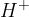 manj.
manj.
Če snov odda proton, se obnaša kot kislina. Če pa prejme proton, se obnaša kot baza. Ista snov se tako lahko obnaša kot baza ali kislina. Lep primer je ravno voda, ki lahko prejme ali pa odda svoje protone. Pri tem se enkrat obnaša kot baza drugič pa kot kislina.
Ker so protolitske reakcije ravnotežne reakcije, lahko za slednje zapišemo konstanto ravnotežja. Poglejmo si primer:
Konstanta kisline nam pomaga ovrednotiti jakost kisline. Močnejša kislina odda skoraj v celoti svoje protone, torej bo ravnotežje pomaknjeno na stran produktov (torej na stran disociirane kisline).
Konstanta kisline 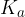 določa moč kisline. Močnejša kot je kislina, višja je vrednost konstante kisline
določa moč kisline. Močnejša kot je kislina, višja je vrednost konstante kisline 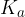 .
.
Pri močnih kislinah, ki popolnoma disociirajo na ione, konstanto kisline niti ne navajamo.
Večprotonske kisline imajo na razpolago več protonov in zato reagirajo z njo v več stopnjah. Za vsako stopnjo lahko zapišemo konstanto protolize. Poglejmo si primer fosforjeve (V) kisline.
Tako kot za kisline tudi za baze lahko napišemo konstanto ravnotežja oziroma konstanto baze 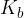 .
.
Konstanta baze 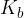 določa moč baze. Močnejša kot je baza, višja je vrednost konstante baze
določa moč baze. Močnejša kot je baza, višja je vrednost konstante baze 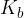 .
.
Tudi pri preprostih bazah imamo lahko več hidroksidnih ionov na razpolago. Le-ti se sproščajo postopoma zato protolizo take baze zapišemo po stopnjah. Poglejmo si primer protolize baze za 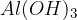 .
.
Elektroliti so tekočine, ki prevajajo električni tok. Mednje uvrščamo:
taline ionski snovi (prosti ioni),
raztopnie soli (prosti ioni),
raztopine kislin in baz (disociirane kisline in base so v ionski obliki).
Prosti ioni se lahko gibljejo in zato prenašajo naboj. Večja kot je koncentracija prostih ionov, boljša je prevodnost take raztopine. Iz tega lahko sklepamo, da so močne kisline in baze dobri prevodniki saj popolnoma disociirajo. Močne kisline in baze so torej močni elektroliti, šibke kisline in baze, ki nepopolnoma disociirajo, pa so šibki elektroliti.