Osebne zbirke


Prvi zakon termodinamike pravi, da je sprememba notranje energije opazovane snovi enaka dovedeni (ali odvzeti) toploti in delu:

Toplotno energijo dodajamo npr. s pomočjo plinskega gorilnika ali odvzemamo tako, da pustimo, da se ohlaja.
Prvi zakon termodinamike pravi, da se notranja energija snovi lahko spreminja zaradi prejete (ali oddane) toplote in prejetega ali oddanega dela:
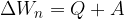
Delo A je lahko pozitivno ali negativno:
Če je delo pozitivno, dodajamo snovi notranjo energijo. Primer pozitivnega dela je, če drgnemo železo ob železo npr. s pomočjo pile, stiskamo zrak v zračnico kolesa s pomočjo tlačilke. V obeh primerih mi opravimo delo in se zato notranja energija snovi poveča. Telo (ali plin) se segreje.
Če snov opravlja delo, je to delo negativno. V skladu z energijskim zakonom to namreč pomeni, da se manjša notranja energija snovi. Primer je železna palica, ki se ob segrevanju razteza in pri tem odrine drugo telo (opravi delo).
Prvi zakon termodinamike velja za vse snovi. Zaradi enostavnosti se bomo v nadaljevanju omejili na idealni plin.
Ločeno bomo opazovali, kaj se zgodi, če plin segrevamo pri stalnem volumnu (npr. v zaprti posodi) ali pa pri stalnem tlaku (ki ga npr. določa sila teže bata, ki ga odriva plin pri razpenjanju.
Vzemimo idealni plin in ga segrevajmo. Najprej ga segrevamo v zaprti posodi, to je pri konstantnem volumnu - slika 1 a).
Celotna energija segrevanja gre v notranjo energijo plina, saj se plin zaradi konstantnega volumna ne more razpenjati, da bi opravljal delo.

Če snov (idealni plin) segrevamo pri stalnem volumnu, takrat nimamo opravljenega dela. Tedaj velja:
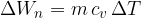
Specifični toploti smo dali indeks v zato, ker se proces vrši pri stalnem volumnu.
V naslednjem koraku dopustimo, da se plin segreva in razpenja pri stalnem tlaku slika 1 b). V tem primeru je sprememba notranje energije v skladu z zakonom termodinamike enaka dovedeni toploti pri stalnem tlaku in delu, ki ga opravi snov pri razpenjanju.
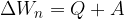
Dodana toplota pri stalnem tlaku je:
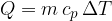
Specifični toploti smo dali indeks "p" zato, ker se proces vrši pri stalnem tlaku p.
Ko se plin razpenja, se mu veča volumen in opravlja delo, npr. premakne bat za za neko razdaljo. Za opravljeno delo se mu zmanjša notranja energija, delo je torej negativno.
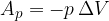
Enačba (1) se sedaj glasi:
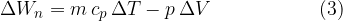
Notranja energija pri segrevanju plina pri konstantnem tlaku se poveča za dovedeno toploto in zmanjša za delo, ki ga je opravil plin med razpenjanjem.
Če snov (idealni plin) segrevamo pri stalnem tlaku, se segreva in razpenja - opravlja delo:
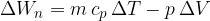
Namesto leve strani enačbe (3) uporabimo izraz za notranjo energijo (2). Na ta način lahko izpeljemo povezavo med specifično toploto pri stalnem tlaku 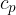 in specifično toploto pri stalnem volumnu
in specifično toploto pri stalnem volumnu 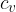 .
.
Zamislimo si, da na enak način segrevamo sistem najprej pri enakem volumnu in nato še pri enakem tlaku. Sprememba notranje energije je v obeh primerih enaka:
Specifična toplota pri stalnem tlaku je vedno večja, kot pri stalnem volumnu. Pri stalnem tlaku se plin namreč razpenja in opravlja delo.
Za idealni plin je povezava med specifično toploto pri stalnem tlaku in stalnem volumnu:
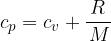
Tu je R splošna plinska konstanta in M kilomolska masa.
V dobljeno enačbo:
Razmerje med specifično toploto pri stalnem tlaku in stalnem volumnu označimo z grško črko kapa 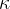 :
:
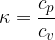
Za enoatomni plin je to razmerje:
Za idealni enoatomni plin je povezava med specifično toploto pri stalnem tlaku in stalnem volumnu:
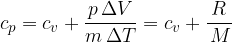
Specifična toplota pri stalnem tlaku pa je:
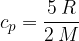
Specifična toplota pri stalnem volumnu je:
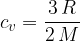
Njuno razmerje pa je:
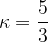
Tu je R splošna plinska konstanta in M kilomolska masa.
Napišimo enačbo (4):
Zrak lahko približno smatramo za dvoatomni plin, saj prevladujeta molekuli dušika 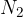 in kisika
in kisika 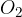 . V primeru dvoatomnega plina je:
. V primeru dvoatomnega plina je:
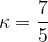
Specifična toplota pri stalnem volumnu je za poljuben idealni plin:
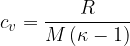
V primeru dvoatomnega plina je:
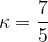
Za nekatere pline so 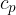 ,
, 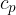 in
in 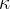 podani v spodnji preglednici:
podani v spodnji preglednici: