Osebne zbirke


Začetne spojine med seboj reagirajo in nastanejo nove spojine, pri tem pa se spojine v reakcijah držijo razmerja, ki ga narekujejo posamezne enačbe. V gradivu Stehiometrija smo obravnavali idealne reakcije, kjer so bile količine reaktantov med seboj v idealnem (stehiometričnem) razmerju. Kaj pa če količine reaktantov niso v idealnem razmerju?
Kadar imamo nesorazmerne količine reaktantov, reakcije potekajo vse dotlej, dokler enega izmed reaktantov ne zmanjka. Reaktant, ki je v prebitku (presežni reaktant) ostane po končani reakciji v reakcijski mešanici, drugi pa iz reakcijske mešanice izgine.
Za primer vzemimo reakcijo, ko reagirata vodik in dušik. Urejena kemijska enačba za to reakcijo je:
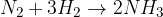
Iz enačbe preberemo, da za eno molekulo dušika potrebujemo tri molekule vodika. Poglejmo si shemo, kjer je prikazan presežek dušika v reakcijski mešanici:
Shema prikazuje:
na levi strani imamo molekule vodika in dušika.
na desni strani imamo molekule amoniaka in dušika.
Pri reakciji so se porabile vse molekule vodika  , medtem ko je nekaj molekul dušika ostalo nespremenjenih in so v reakcijski posodi tudi po zaključeni reakciji.
, medtem ko je nekaj molekul dušika ostalo nespremenjenih in so v reakcijski posodi tudi po zaključeni reakciji.
Stehiometrične naloge s presežkom reaktantov računamo na podoben način kot navadne stehiometrične reakcije. Razlika je le v tem, da moramo najprej prepoznati reaktant v presežku.
Postopni koraki za reševanje stehiometričnih nalog s presežkom reaktantov so:
napišemo razmerje množin med snovjo, ki jo iščemo, in snovjo, ki je podana;
izračunamo množino reaktantov;
glede na zapisano razmerje množin preverimo ali v reakciji nastopa snov v presežku;
izračunamo količino presežne snovi, ki se porabi med reakcijo s pomočjo pravil za računanje stehiometričnih reakcij.
Poglejmo si postopek reševanja takih nalog na praktičnem primeru.