Osebne zbirke


V gradivu Entalpija smo v poglavju standardna tvorbena entalpija govorili o energetski spremembah, ki nastanejo pri tvorbi enega mola snovi iz elementarnih spojin. Pri tem smo v tabeli navedli standardne tvorbene entalpije nekaterih snovi, ki so bile pridobljene eksperimentalno. Le-te lahko pridobimo tudi teoretično s pomočjo standardne vezne entalpije.
Vezna entalpija 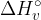 je energija, ki jo moramo dovesti, da prekinemo vezi v 1 molu plinaste snovi.
je energija, ki jo moramo dovesti, da prekinemo vezi v 1 molu plinaste snovi.
V procesu prekinjanja vezi in nastanka novih snovi, se energija:
porablja za prekinjanje vezi,
sprošča pri vzpostavljanju vezi.
Koliko energije porabimo za prekinitev vezi in koliko energije se sprosti ob ustvarjanju novih vezi je odvisno od vrste vezi. Vezna entalpija je povezana z močjo vezi. Močnejša kot je vez, večjo vezno entalpijo ima.
Pri računanju posameznih energetski sprememb moramo upoštevati prav vsako vez, ki se cepi ali vzpostavlja. Poglejmo kako.
Pri tvorbi novih snovi je potrebno:
vezi v reagentih najprej prekiniti,
nato pa v produktih vzpostaviti nove vezi.
Ko vemo, katere vezi se prekinjajo ali vzpostavljajo, lahko izračunamo približek za reakcijsko entalpijo. Pri tem uporabimo naslednjo enačbo:
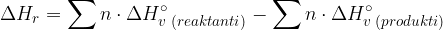
Poglejmo si na primeru kako uporabiti enačbo in izračunati reakcijsko entalpijo.
V spodnji tabeli so zbrane vezne entalpije, ki jih uporabimo pri računanju približkov za reakcijske entalpije.