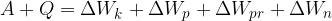Osebne zbirke


Termodinamika je posebna veja fizike, ki ji kratko rečemo toplota. Proučuje toplotno ravnovesje toplotno izoliranih sistemov, energijske zakone, fazne spremembe - t.j. spremembe agregatnega stanja itd. Več o tem bomo zvedeli v nadaljevanju.
V naslednjih podpoglavjih bomo:
spoznali, kaj je notranja energija;
spoznali zakon termodinamike, ki povezuje notranjo energijo, toploto in temperaturo;
spoznali termodinamične spremenljivke in kako merimo temperaturo.
spoznali vrste fizikalnih sistemov (odprt, zaprt in izoliran sistem).
razširili bomo dosedanje vedenje o energijskem zakonu.
H kinetični energiji, potencialni energiji in prožnostni energiji bomo v tem gradivu dodali še notranjo energijo. Označimo jo z:
Naštejmo nekaj oblik notranje energije:
Kinetična energija zaradi gibanja molekul snovi.
Potencialna energija, ki jo povzročajo medmolekularne sile.
Notranja energija v molekulah in atomih.
V tem poglavju ne bomo upoštevali potencialne energije zaradi medmolekularnih sil. Ta sila je majhna pri dovolj razredčenih plinih, ki jih bomo obravnavali kot idealni plin, v katerem medmolekularno silo zanemarimo. Prav tako ne bomo upoštevali notranje energije v molekulah in atomih. Molekule si predstavljamo kot toge kroglice, ki trkajo med sabo in ob steno posode. Celotna notranja energija bo zato zajeta v neurejenem gibanju (kinetični energiji) molekul.
Za proučevanje termodinamike uporabljamo količine, ki jim pravimo termodinamične spremenljivke. Osnovne termodinamične spremenljivke so:
volumen,
tlak,
masa,
temperatura.
Prve tri so nam znane, četrto, temperaturo, pa bomo spoznali v tem podpoglavju. Spoznali bomo tudi povezavo med toploto in temperaturo.
V termodinamiki se uporablja absolutna temperatura. Oznako ima T, enota pa je K (Kelvin). Temperaturo nič Kelvina imenujemo absolutno ničlo. Nižja temperatura ni možna.
Iz vsakdanjega življenja smo vajeni Celzijeve temperaturne lestvice z enoto 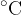 (stopinje Celzija). V večini primerov, ko gre za absolutno temperaturo ali temperaturno razliko, bomo uporabili kar oznako T.
(stopinje Celzija). V večini primerov, ko gre za absolutno temperaturo ali temperaturno razliko, bomo uporabili kar oznako T.
Oglejmo si primerjavo obeh lestvic:
Obe lestvici sta številsko premaknjeni za 273 enot. Temperaturo med Kelvini in Celziji pretvarjamo tako:

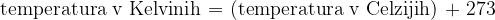
Pri računih, kjer moramo vnesti samo temperaturno razliko 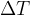 , je temperaturna razlika v Kelvinih številsko enaka temperaturni razliki v stopinjah Celzija.
, je temperaturna razlika v Kelvinih številsko enaka temperaturni razliki v stopinjah Celzija.
Najpomembnejše termodinamične spremenljivke so tlak 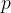 , volumen
, volumen 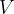 in temperatura
in temperatura 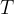 .
.
Temperatura T je v Kelvinih (K) izraženo toplotno stanje telesa. Celzijevo lestvico dobimo, če prištejemo Kelvinovi število 273.
Če opazujemo samo razliko temperatur, lahko uporabljamo Celzijevo ali Kelvinovo skalo, saj sta razliki temperatur številsko enaki.
Da ne prihaja zmede v oznakah, temperaturo v Kelvinih označimo s 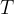 , temperaturo v Celzijih pa z
, temperaturo v Celzijih pa z 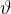
Natančno meritev temperature omogoča plinski termometer, ki deluje na osnovi plinske enačbe. Ta pravi, da je za določeno množino plina produkt tlaka in volumna sorazmeren temperaturi. Sorazmernostna konstanta naj bo K.
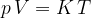
S plinskim termometrom lahko izmerimo temperaturo tako, da izmerimo tlak pri stalnem volumnu ali volumen pri stalnem tlaku. Temperaturo izračunamo z enačbo:
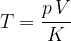
Faktor K je natančno razložen v poglavju Plinska enačba.
Plinski termometer se uporablja kot merilni etalon (uradno primerjalno merilo), za praktično merjenje temperature pa je precej neprikladen. V praksi uporabljamo termometre, ki izkoriščajo odvisnost raztezka snovi od temperature (živosrebrni termometer, bimetalni termometer) ali pa elektronski termometer. Za vse je značilno, da so uporabni samo za omejeno temperaturno območje meritev.
Termometri na sliki so:
Klasičen termometer (na sliki 2 levo), izkorišča raztezanje tekočine (npr. obarvan alkohol, živo strebro itd.) s temperaturo.
Bimetalni termometer (na sliki 2 sredina), vsebuje dva zvarjena lističa kovine, ki se zaradi temperature različno raztezata. Posledica različnih raztezkov je krivljenje lističev, ki je sorazmerno temperaturi.
Elektronski termometer (na sliki desno) je lahko:
temperaturno odvisni električni upornik; v tem primeru merimo tok skozi upornik pri stalni napetosti. Tok je odvisen od temperature T.
termoelement; v tem primeru imamo dva spoja dveh kovin. V kolikor sta spoja na dveh različnih temperaturah, nastane med spojema električna napetost, ki je odvisna od temperaturne razlike.
Toplota je gibanje (kinetična energija) molekul v plinih in kapljevinah ali nihanje molekul v trdni snovi.
Gibanje molekul najlaže opazujemo v kapljevini. V kapljevino damo drobna plavajoča zrnca. Zrnca se zaradi trkov gibajočih molekul kapljevine gibajo neurejeno po nekakšnih cikcakastih tirih. Gibanje je tem bolj živahno, čim večja je temperatura kapljevine. To gibanje se imenuje Brownovo gibanje.
Podobno gibanje je tudi v plinih. V trdnih snoveh se kaže kinetična energija v nihanju molekul okoli prostega prostora, ki je na razpolago molekuli.
Ko snov segrevamo, dodajamo toploto Q in s tem večamo kinetično energijo molekul. Molekule lahko s trki prenašajo kinetično energijo iz toplejše na hladnejšo snov, s katero je v toplotnem stiku. Pri tem se toplejša snov ohlaja (oddaja toploto, hitrost molekul se manjša) hladnejša pa segreva (sprejema toploto, hitrost molekul narašča). Če sta snovi v toplotno izolirani posodi, se prej ko slej vzpostavi toplotno ravnovesje: vse molekule imajo enako kinetično energijo - so na isti temperaturi.
Toplota Q je energija, ki povzroča spremembo hitrosti (in s tem kinetične energije) molekul.
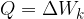
Oznaka za toploto je Q, enota pa je enaka kot za vse druge vrste energij: Joule (džul) z oznako J.
Toplota se preko toplotnega stika s trki molekul prenaša iz toplejšega na hladnejše telo.
V poglavju termodinamike bomo kot notranjo energijo upoštevali samo kinetično energijo zaradi toplotnega gibanja molekul.
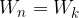
Najlaže jo proučujemo, če opazujemo gibanje molekul v idealnem plinu. To je plin, ki je dovolj razredčen, da lahko zanemarimo medmolekularne sile. Molekule si predstavljajmo kot toge kroglice, ki se naključno gibajo po prostoru ter elastično trkajo med sabo in ob steno posode.
Kinetična energija molekule v idealnem plinu je sorazmerna absolutni temperaturi. Faktor sorazmernosti je Boltzmannova konstanta.
Kinetična energija molekule v idealnem plinu je sorazmerna absolutni temperaturi T.

kjer je k Boltzmannova konstanta:
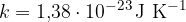
V kolikor imamo v zaprtem prostoru N molekul idealnega plina, je skupna kinetična energija vseh molekul - glej enačbo (1):

Število molekul N raje izrazimo z maso m - glej Zgradba snovi:

kjer je M število kilomolov in u atomska enota mase:
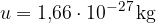
Enačbo (3) vstavimo v enačbo (2) in dobimo:
Specifična toplota je izpeljana za stalni volumen, saj je bil plin v posodi zaprt in se ni mogel razpenjati. Velja za žlahtne pline, kjer se atomi ne povezujejo v večje molekule - npr. helij, neon, argon itd. Pri večatomnih molekulah ni notranja energija samo v kinetični energiji molekule, pač pa tudi v gibanju atomov znotraj molekule. Zato je njihova notranja energija večja od izračunane.
Zelo pogosto pa opazujemo spremembo energije, ko spreminjamo samo temperaturo. Ker gre za spremembo toplote, enačbo označimo s 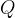 in zapišemo:
in zapišemo:
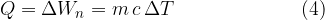
Enačba (4) velja za vse snovi, ne samo za idealni plin. Segrevanje snovi se lahko vrši pri stalnem tlaku ali pri stalnem volumnu. Glede na to dodamo specifični toploti c indeks p ali v - glej tudi Prvi zakon termodinamike.

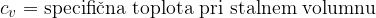
Produkt mase in specifične toplote imenujemo toplotna kapaciteta C. Pove nam, za koliko se je povečala toplota Q snovi, če jo segrejemo za 1 K.
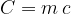
Enačba (4) se sedaj glasi:
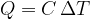
Dovedena ali odvedena toplota Q je sorazmerna masi in spremembi temperature:
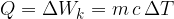
Faktor sorazmernosti je specifična toplota:
Specifična toplota pove, koliko toplote potrebujemo, da segrejemo maso 1 kg za 1 K ali koliko toplote moramo snovi odvzeti, da jo ohladimo za 1 K.
Za enoatomne molekule plina izračunamo specifično toploto pri stalnem volumnu s pomočjo enačbe.
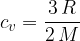
Produkt mase in specifične toplote je toplotna kapaciteta C.
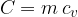
Tabela specifičnih toplot pri stalnem tlaku za nekatere snovi:
Opazujmo sistem, v katerem se dogajajo fizikalne spremembe. Opazovan sistem je lahko odprt, zaprt ali izoliran.
odprt sistem
Odprt sistem lahko z okolico izmenjuje toploto (notranjo energijo), delo in tudi maso.
zaprt sistem
Zaprt sistem lahko z okolico izmenjuje samo toploto (notranjo energijo) in delo. Masa ostaja enaka.
izoliran sistem
Izoliran sistem ne more z okolico izmenjati niti dela niti toplote.
Razširimo dosedanje znanje o energijskem zakonu.
Opazujemo zaprt sistem, to je sistem, ki lahko izmenjuje z okolico toploto in delo, ne more pa izmenjati masnih delcev.
Razširjen energijski zakon se glasi: delo sile in sistemu dovedena ali odvzeta toplota sta enaki spremembi celotne energije sistema:
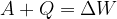
Sprememba celotne energije sistema je enaka spremembi kinetične energije, potencialne energije, prožnostne energije in notranje energije sistema.
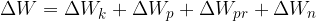
Če fizikalnemu sistemu dovedemo (ali odvzamemo) delo in toploto, se mu spremeni celotna energija:
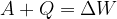
Celotna energija sistema je z upoštevanjem notranje energije enaka vsoti kinetične, potencialne, prožnostne in notranje energije:
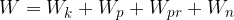
Splošna oblika energijskega zakona je: