Osebne zbirke


Kemijska enačba je pregleden zapis za kemijsko reakcijo. Enačba je sestavljena iz treh delov:
na levi strani zapišemo reaktante - to so snovi, ki vstopajo v reakcijo
na desni strani zapišemo produkte - to so snovi, ki nastanejo v reakciji
vmes zapišemo puščico, ki označuje smer kemijske reakcije.
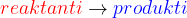
Reaktantov in produktov je običajno več, zato jih ločimo z znakom + za seštevanje.
Število atomov vsakega elementa na levi strani kemijske enačbe mora biti enako tudi na desni strani. Atomi so le urejeni drugače, v nove snovi.
Če število atomov vsakega elementa ni enako na obeh straneh enačbe, potem moramo reakcijo urediti. S tem postopkom uskladimo števila vseh elementov med reaktanti in produkti.
Preden se lotimo postopka urejanja kemijske reakcije, poglejmo, na katere načine običajno zapišemo reakcijo.
Kemijsko reakcijo lahko predstavimo na več načinov. Najpogosteje uporabljamo:
simbolni zapis kemijske reakcije,
besedni zapis kemijske reakcije,
modelni prikaz kemijske reakcije.
Reaktante in produkte v kemijski enačbi zapišemo z njihovimi simboli in formulami. Ob simbolih in formulah reaktantov in produktov lahko navedemo tudi agregatno stanje elementa oziroma molekule.
V kemijskih enačbah zasledimo 4 stanja:
trdno agregatno stanje, ki ga označimo s črko s (oznaka za angleško besedo solid);
tekoče agregatno stanje, ki ga označimo s črko l (oznaka za angleško besedo liquid);
plinasto agregatno stanje, ki ga označimo s črko g (oznaka za angleško besedo gas);
vodna raztopina snovi, kar označimo s črkama aq (oznaka za angleško besedo aqueous).
Črko, ki označuje agregatno stanje, zapišemo v oklepaj in zapišemo kot podpisano besedilo takoj za zapisom molekulske formule ali simbola.
Kadar zapisujemo elemente s simboli, ob njih navedemo njihovo običajno agregatno stanje, kot je podano v periodnem sistemu elementov.
Pri molekulah, ki jih poznamo iz vsakdanjega življenja (npr. voda, ogljikov dioksid, natrijev klorid) zapišemo agregatno stanje, v katerem se snov nahaja pri sobni temperaturi. Za manj poznane molekule imamo agregatno stanje podano v samih nalogah.
Besedni zapis kemijske reakcije je zapis kemijske reakcij, kjer namesto simbolov in molekulskih formul navedemo imena reaktantov in produktov.
Modelni prikaz kemijske reakcije uporabljamo, da nazorno prikažemo, kako se atomi pri kemijski reakciji med sabo povežejo. Za prikaz reaktantov in produktov pri modelnem prikazu uporabljamo kalotne ali kroglične modele.
Modelni prikaz je predvsem primeren za prikaz kemijskih reakcij, kjer nastopajo spojine, ki so zgrajene iz največ štirih atomov. V kolikor spojine z več atomi, je modelni prikaz kemijske reakcije nepregleden.
Ko zapisujemo kemijske enačbe, moramo paziti, da vsako kemijsko enačbo tudi uredimo.
Urejena kemijska enačba pomeni, da imamo na levi strani puščice enako število atomov nekega elementa kot na desni strani reakcijske puščice.
Število atomov posameznega elementa na levi ali desni strani kemijske enačbe uskladimo tako, da povečamo število atomov elementa na tisti strani, kjer imamo manjše število atomov danega elementa.
Pri tem zapišemo številko (koeficient) pred:
izbrani element, ko ta element nastopa sam zase ali
želeno molekulsko formulo, ko ta element nastopa znotraj molekule.
Pri urejanju kemijske reakcije ne smemo spreminjati števila elementov v molekulski formuli. Vsaka molekula, ki nastopa v enačbi, je natanko določena in se ne sme spremeniti.
Če moramo povečati število elementov, ki nastopajo v molekuli, potem lahko koeficient dopišemo pred molekulsko formulo. S tem povečamo število danih molekul, ki nastopajo v reakciji. Hkrati torej povečamo števila vseh elementov, ki nastopajo v izbrani molekuli.
Najmanj dela z urejanjem kemijskih enačb imamo, če se držimo ustreznega vrstnega reda elementov.
Atome urejamo po sledečem vrstnem redu:
uredimo kovine,
uredimo nekovine,
uredimo vodike 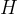 ,
,
uredimo kisike 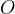 .
.
Če v kemijski enačbi nimamo katerega od naštetih elementov, izpustimo korak in se lotimo urejanja naslednjega atoma. To pomeni, da če v kemijski reakciji ni prisotnega vodika, izpustimo korak urejanja vodika in se lotimo urejanja kisikov.
Zakon o ohranitvi mase se osredotoča na maso reaktantov in produktov v kemijski reakciji. Ta zakon izhaja iz dejstva, da masa ne more iz nič nastati in ne more izginiti.
Zakon o ohranitvi mase nam pove, da se masa snovi med kemijsko reakcijo ne spremeni. Masa reaktantov je enaka kot masa produktov.
Ta zakon velja za vse kemijske reakcije.
Pri urejanju kemijske reakcije mora biti število atomov elementov na levi in desni strani enako zato, da zadostimo zakonu o ohranitvi mase. Le tako je masa reaktantov enaka masi produktov.
Maso reaktantov in produktov izračunamo s pomočjo:
koeficientov, ki so zapisani v kemijski reakciji, in pa
Če maso med kemijsko reakcijo merimo s tehtnico, moramo biti pozorni tudi na reaktante in produkte v plinastem agregatnem stanju.
Pri kemijskih reakcijah se posebej posvečamo masi in posebej energiji:
Pri masi moramo upoštevali zakon o ohranitvi mase,
ko pa gledamo energijo kemijske reakcije, pa upoštevamo zakon o ohranitvi energije.