Osebne zbirke


Atom je najmanjši znani delec s kemijskimi lastnosti posameznega elementa, ki ga kemijsko ne moremo razstaviti na manjše delce. Atomov ne moremo videti s prostim očesom.
Atom je sestavljen iz jedra, v katerem najdemo nevtrone in protone. Prostor okoli jedra imenujemo elektronska ovojnica, kjer najdemo elektrone:
Kot lahko že s skice razberemo, atom sestavljajo:
protoni; označimo s 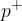 ; to so delci, ki imajo pozitiven naboj;
; to so delci, ki imajo pozitiven naboj;
elektroni; označimo z 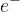 ; to so delci, ki imajo negativen naboj;
; to so delci, ki imajo negativen naboj;
nevtroni; označimo s 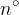 ; to so delci, ki nimajo naboja, oziroma lahko rečemo, da so nevtralni.
; to so delci, ki nimajo naboja, oziroma lahko rečemo, da so nevtralni.
Naboj protonov in elektronov se medsebojno izniči, zato je atom navzven električno nevtralen.
Atom ima vedno enako število protonov in elektronov, zato je ta številka hkrati tudi vrstno število elementa.
Vrstno število elementa je:
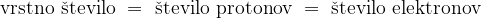
Masno število pa je seštevek protonov in nevtronov. Le tega ne najdemo v periodnem sistemu in ni enako relativni atomski masi.
Seštevek protonov in nevtronov predstavlja masno število.
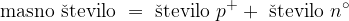
Že v osnovni šoli smo se učili hitrega skiciranja atoma. Skiciramo ga tako, da:
narišemo jedro,
okrog jedra narišemo koncentrične kroge, ki so ponazarjajo lupine,
porazdelimo elektrone po lupinah.
Pri razporejanju atomov upoštevamo sledeče:
prva lupina lahko sprejme največ 2 elektrona,
vse nadaljnje lupine sprejmejo po 8 elektrornov.
Elektronska ovojnica (ali tudi lupina) je prostor po katerem krožijo elektroni. Natančneje jo spoznamo v gradivu Elektronska ovojnica in orbitale.
Poglejmo si na praktičnem primeru, kako bi na hitro ponazorili atom.
V gradivu Ionska, kovalentna in kovinska vez bomo spoznali, kako se naši atomi povezujejo med seboj. Pri tem bomo večkrat uporabili pojme, ki jih spoznamo v nadaljevanju.
Poglejmo skico našega žveplovega atoma. Vidimo, da ima na zadnji lupini (najbolj zunanji izmed ovojnic) šest elektronov. Ti so pomembni pri tvorbi vezi med žveplom in drugimi atomi. Ker ležijo na zunanji lupini jih imenujemo zunanji elektroni oziroma valenčni elektroni.
Valenčni elektroni (ali zunanji elektroni) so elektroni, ki so prisotni na zadnji lupini nekega atoma. Pri atomih glavnih skupin (I., II., III., IV., V., VI., VII., VIII.) število zunanjih elektronov ustreza številu skupine, v kateri se atom nahaja.
Pri risanju nastanka vezi med atomi običajno upoštevamo samo valenčne elektrone. Nek atom lahko zato ponazorimo le z njegovim simbolom in valenčnimi elektroni.
Ko rišemo valenčne elektrone, običajno najprej porazdelimo štiri elektrone, vsakega posebej okoli simbola elementa. Kolikor elektronov še ostane, pa jih "poparčkamo" z že razporejenimi.
Poglejmo še, kako imenujemo valenčne elektrone (glej sliko 12):
Elektrone, ki ostanejo sami, imenujemo samski elektroni.
Pare elektronov pa imenujemo nevezni elektronski pari.