Osebne zbirke


Adicija je kemijska reakcija, pri kateri se povežeta dve molekuli v spojino z večjo molekulsko maso. Elektrofilne adicije pa so adicije, v katerih pride v osnovnih molekulah do sprememb pri nenasičenih (dvojnih ali trojnih) vezeh.
Pri postopku vezave zunanjih molekul na ogljike, se ena izmed nenasičenih vezi porabi za vezavo novih skupin in sicer lahko:
iz dvojne nastane enojna vez (slika 2 A),
iz trojne nastane dvojna vez (slika 2 B).
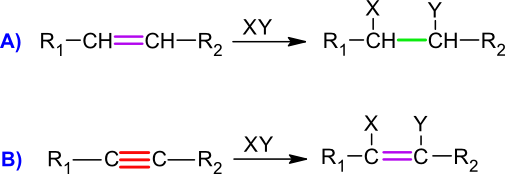
Slika 2: Spreminjanje nasičenosti pri elektrofilnih adicijah: A) dvojna vez preide v enojno, B) trojna vez preide v dvojno.
Na dvojno ali trojno vez se lahko preko mehanizma elektrofilne adicije vežejo različne molekule. Glede na to, katera molekula se veže poznamo:
halogeniranje: na molekulo se veže 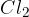 ali
ali 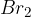 ;
;
hidrogeniranje: na molekulo se veže 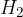 ;
;
hidriranje: na molekulo se veže 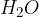 ;
;
hidrogenhalogeniraje: na molekulo se veže 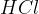 in
in 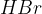 .
.
Poglejmo si vsako od elektrofilnih adicij podrobneje.
Halogeniranje poznamo že iz substitucij, kjer smo obravnavali zamenjavo oziroma dodajanje halogenih elementov v organske molekule. Razlika med substitucijami in adicijami je:
Pri substitucijah zamenjave izvajamo postopoma. Šele ko zamenjamo en atom halogena z vodikovim atomomo, začnemo z zamenjavo naslednjega.
Pri adicijah pa v molekulo uvajamo dva atoma hkrati. Pri tem nastanejo direktno disubstituirani produkti.
Pri adicijah na trojne vez imamo dve stopnji:
1.stopnja: Iz trojne vezi nastane dvojna in dobimo disubstituirane produkte.
2. stopnja: Iz dvojne vezi nastane enojna in dobimo tetrasubstituirane produkte.
Poglejmo si na praktičnem primeru, kako poteka proces popolne adicije na trojno vez.
Hidrogeniranje je vezava molekule vodika 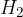 v organsko molekulo. Pri tem:
v organsko molekulo. Pri tem:
iz alkinov nastanejo alkeni in
iz alkenov nastanejo alkini.
Kot katalizator pri teh reakcijah potrebujemo stabilizator vodika, saj je vodik eksploziven. Običajno uporabljamo platino Pt ali paladij Pd.
Hidriranje je izraz za elektrofilno adicijo vode. Pri adiciji vode na dvojno vez nastanejo alkoholi. Do hidriranja pride v kislem okolju: prisotnost kislin pripomore k protolizi vode. Prisotnost kisline označimo v kemijski reakciji.
Tako pri hidriranju kot pri hidrogenhalogeniranju moramo paziti na tako imenovano Markovnikovo pravilo:
Markovnikovo pravilo: pri adiciji se vodikov atom veže na tisti ogljik ob neneasičeni vezi, ki ima že prej vezanih več vodikov.
Pri adiciji vode na trojno vez pride do posebnega pojava: tavtomerizacije. Tavtomerizacija je kemijska sprememba, pri kateri se ena oblika molekule pretvori v svojo izomero. V primeru adicije na trojno vez nastane molekula, ki vsebuje dvojno vez ob kateri je vezana hidroksilna skupina. Pri tej obliki izomerije dvojna vez in in vodikov atom spreminjata položaj.
Poglejmo si tavtomerizacijo nas sliki:
Opišimo tavtomerizacijo na sliki:
elektroni iz dvojne vezi se prestavijo med ogljik in kisik,
proton pa se prenese na ogljik.
V reakciji se izmenjujeta ketonska (ali aldehidna) in enolna (alkohol z dvojno vezjo) oblika molekule. Zato to obliko tavtomerije imenujemo keto-enolna tavtomerija.
Hidrogenhalogeniranje je adicija:
vodikovega klorida ali
vodikovega bromida
Tudi pri tej adiciji moramo biti pazljivi na Markovnikovo pravilo. V primeru hidrogenhalogeniranja se:
na en ogljik veže vodikov atom,
na drugega pa halogeni element.
Pri adiciji na dvojno vez dobimo monosubstituirane alkane - za razliko od kloriranja (halogeniranja), kjer smo dobili disubstituirane produkte.
Konjugirane dvojne vezi so vezi, kjer se izmenjujejo dvojne in enojne vezi:
Pri adicijah na take vezi vedno dobimo dva produkta:
prvi običajno nastane pri adiciji na dva sosednja atoma;
drugi produkt pa nastane po premiku dvojne vezi (glej sliko 26) in vezavo atomov na ogljike s prostimi vezmi.
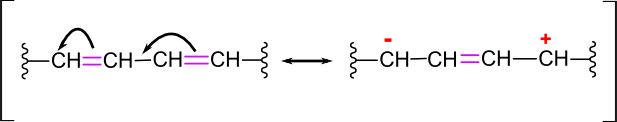
Slika 26: Premik dvojne vezi; eden izmed ogljikov ima prebitek elektronov in ga bo napadel elektrofil, drugi pa ima primanjkljaj.
Poglejmo si praktični primer.