Osebne zbirke


Elektroliza je kemijski proces, v katerem kompleksne spojine razgradimo na osnovne elemente ali molekule. Elektroliza poteka s pomočjo enosmerne napetosti, ki povzroči redoks spremembe. Gre za nasproten proces, kot smo ga spoznali v gradivu Galvanski člen, kjer je spontana kemijska reakcija povzročila enosmerni tok.
Sam proces elektrolize opravljamo v elektrolitski celici. Poglejmo si skico preproste elektrolitske celice:
Opišimo elektrolitsko celico na sliki:
imamo posodo napolnjeno s tekočino, ki prevaja električni tok;
v tekočino sta potopljeni elektrodi (katoda in anoda), ki sta z žico povezani na izvor enosmerne napetosti;
pri tem za elektrodi velja:
katoda je elektroda, ki je negativno nabita;
anoda je elektroda, ki je pozitivno nabita.
Ko vključimo enosmerno napetost se zgodi naslednje:
elektroni pričnejo potovati od anode proti katodi;
pozitivno nabiti delci, kationi, v tekočini potujejo proti katodi (negativno nabiti elektrodi);
negativno nabiti delci, anioni, v tekočini potujejo proti anodi (pozitivno nabiti elektrodi);
V elektrolitski celici ravno tako kot v galvanskem členu potekajo redoks reakcije (oksidacija in redukcija). Če je v galvanskem členu električni tok bil posledica spontanih redoks reakcij, je tukaj obratno: redoks reakcije so posledica enosmernega električnega toka.
Procesi, ki potekajo na posameznih elektrodah, so:
katoda je negativno nabita elektroda in na njej poteka redukcija (kationi sprejemajo elektrone);
anoda je pozitivno nabita elektrona in na njej poteka oksidacija (anioni oddajajo elektrone).
Poglejmo na konkretnem primeru primer elektrolize.
Kot rečeno, lahko elektroliza poteka samo na snoveh (tekočinah), ki prevajajo električni tok. Taka snov so ionske spojine, ki so sestavljene iz ionov. Težava pa je, ker so v ionskih spojinah (pri sobnih pogojih) ioni navadno trdno povezani v kristalno strukturo in niso prosto gibljivi - in posledično ne prevajajo električnega toka.
Če želimo, da elektroliza poteče, mora ionska spojina začeti prevajati tok. Navadno to dosežemo tako, da ionsko spojino:
stalimo in dobimo ionsko talino ali pa
raztopimo dobimo elektrolit.
V obeh primerih se zruši kristalna struktura in dobimo prosto gibljive ione. Taki ioni lahko prevajajo električni tok in s tem lahko poteče tudi elektroliza.
Poglejmo si podrobneje elektrolizo:
ionske taline
ionske raztopine (elektrolit).
Ko ionsko spojino stalimo (ali raztopimo), nastane tekočina, v kateri so posamezni ioni prosto gibljivi in se zato lahko premaknejo k našima elektrodama:
pozitivno nabiti ioni bodo migrirali proti katodi. Tam bodo sprejeli elektron in se reducirali v elementarno kovino.
negativno nabiti ioni bodo migrirali proti anodi. Tam bodo oddali svoj elektron in se oksidirali v elementarno obliko.
Poglejmo si proces na konkretnem primeru.
Raztopina je zmes:
nekega topila; v našem primeru bo topilo kar voda, saj obravnavamo vodne raztopine in
topljenca, to je snovi, ki se raztaplja v vodi; v našem primeru je to ionska snov.
V raztopini se kristalna struktura ionski spojin zruši, pri tem pa se sprostijo posamezni ioni. Ioni prosto plavajo po topilu. Ker so ioni prosto gibljivi, raztopina prevaja električni tok, zato lahko poteče elektroliza.
Splošno pravilo je, da v kolikor imamo v raztopini prisotne ione atomov prve in druge skupine periodnega sistema, na katodi poteče redukcija vode.
Pri elektrolizi čiste vode vodno molekulo razkrojimo na elementarne spojine in sicer na
vodik in
kisik.
Da lahko elektroliza poteče, voda mora disociirat na:
oksonijev ion 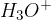 , ki ga poenostavljeno zapišemo kar
, ki ga poenostavljeno zapišemo kar 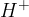 in
in
hidroksidni ion 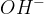 .
.
Ta dva iona omogočata prevodnost vode in s tem omogočata elektrolizo. Težava pa je, ker ima čista voda nizko koncentracijo oksonijevih in hidroksidnih ionov, zato je čista voda slab prevodnik. Zato čisti vodi dodamo snov, ki se ionizira in s tem poveča prevodnost vode. Običajno dodajamo žveplovo (VI) kislino ali kake druge ionske snovi, ki ne prispevajo h končnim produktom elektrolize.
Kompleksni oksoioni (sulfatni ion, nitratni ion...) so zanimivi zato, ker njihova prisotnost poveča prevodnost vode in zato pride do oksidacije vode na anodi.
Ob prisotnosti kompleksnih oksoionov na anodi poteče sledeča reakcija (za ponazoritev vzamemo oksoion 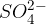 ):
):
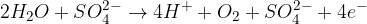
Pri tem se oksoioni ne spremenijo, izhajajo pa mehurčki kisika.