Osebne zbirke


V tem gradivu si bomo podrobneje ogledali elektronsko strukturo ogljikovega atoma in ob tem razložili množičnost spojin, ki jih lahko tvori ogljikov atom.
Iz periodnega sistema elementov lahko razberemo, da ima ogljikov atom 6 elektronov (to razberemo iz vrstnega števila). V sledečem diagramu (slika 1) razporedimo elektrone po orbitalah.
Pri tem so orbitale urejene po energijskih nivojih. Višje kot je postavljena orbitala, višjo energijo lahko zasedajo elektroni. Iz diagrama lahko razberemo, da je elektronska konfiguracija ogljika:
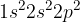
Na diagramu opazimo, da dva izmed elektronov nista v paru. Zato sta torej potencialna kandidata za tvorjenje kovalentnih vezi. Vemo, da je kovalentna vez skupni vezni elektronski par.
Vsak izmed prostih ogljikovih atomov bo iskal še en elektron iz sosednjega atoma, s katerim bi lahko tvoril tak skupni par. Zato sklepamo, da bi moral ogljik tvoriti največ dve kovalentni vezi. Že samo iz poznavanja ogljikovodikov pa vemo, da ogljik tvori štiri enakovredne vezi, to pomeni da so vse štiri vezi:
enako dolge
enako močne
Tvorbe štirih vezi ne moremo razložiti z zgornjim razmislekom. Ta pojav pa se da obrazložiti z matematičnim postopkom, ki mu pravimo hibridizacija.
Hibridizacija je matematični postopek, pri katerem vzamemo orbitale in jih preuredimo. S tem je mišljeno, da vzamemo energijo orbital in prostor, ki ga te zasedajo. Kar nas zanima, je energija in oblika novih orbital, ki jih lahko dobimo s tem postopkom.
Pogledali si bomo tri vrste hibridizacije:
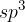 -hibridizacija
-hibridizacija
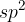 -hibridizacija
-hibridizacija
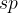 -hibridizacija
-hibridizacija
Pri vsakem izmed postopkov bomo povedali:
katere orbitale so bile uporabljene in
kako naj bi izgledal ogljikov atom po tej teoriji.
Prvi matematični postopek, ki so ga uporabili, da bi razložili vezi ogljikovega atoma, je 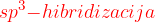 . Pri tem postopku uporabimo:
. Pri tem postopku uporabimo:
eno s-orbitalo
tri p-orbitale
Lahko opazimo, da nam že samo ime hibridizacije 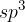 pove, katere orbitale so bile uporabljene; s-orbitala
pove, katere orbitale so bile uporabljene; s-orbitala
in vse tri p-orbitale.
Uporabimo torej štiri orbitale različnih energij in oblik, ter jih preoblikujemo v štiri orbitale enakih oblik in energij - enakovredne orbitale. Obliko orbital si poglejmo s pomočjo energetskega diagrama:
Iz desnega diagrama po hibridizaciji (slika 2) vidimo, da je energija novih hibridiziranih orbital nekje med:
predhodnimi p-orbitalami, ki imajo višjo energijo,
in s-orbitalo, ki ima nižjo energijo.
V samih diagramih imamo tudi drugače razporejene elektrone. Zdaj lahko opazimo, da ima tako predelan ogljikov atom štiri proste elektrone. Ti štirje elektroni:
potujejo po enakih prostorih,
imajo enako energijo.
Ko elektroni tvorijo vezi (skupne elektronske pare), so si vse vezi med seboj enakovredne.
Sedaj pa poglejmo obliko osnovnih in novih orbital. Obliki s- in p- orbital že poznamo (slika 3). Če ju poljudno opišemo, imajo s-orbitale obliko krogle, p-orbitale pa obliko "pentlje".
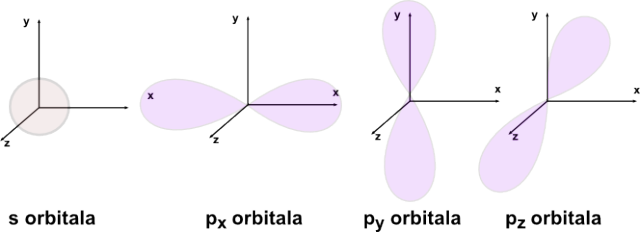
Slika 3: Oblika posameznih orbital; od leve prosti desni s orbitala in tri p orbitale (razporejene prostorsko)
Hibridizirana orbitala pa ima slednjo obliko:
Če jo poljudno opišemo, bi lahko rekli, da ima obliko "kravate".
Torej ima 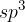 -hibridiziran ogljikov atom štiri nove orbitale (slika 5), ki jih najbolje razporedimo v prostoru v tetraedrično obliko. Vsaka izmed orbital je usmerjena v enega izmed kotov tetraedra. Ogljikov atom v tem primeru izgleda nekako takole:
-hibridiziran ogljikov atom štiri nove orbitale (slika 5), ki jih najbolje razporedimo v prostoru v tetraedrično obliko. Vsaka izmed orbital je usmerjena v enega izmed kotov tetraedra. Ogljikov atom v tem primeru izgleda nekako takole:
Tak ogljikov atom lahko tvori štiri enojne vezi.
Pri 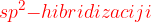 uporabimo:
uporabimo:
eno s-orbitalo
dve p-orbitali
Uporabimo torej tri orbitale, ki jih preoblikujemo v tri hibridizirane orbitale. Energijo takih orbital si poglejmo si s pomočjo energetskega diagrama :
Iz diagrama po hibridizaciji (slika 6) vidimo, da je energija novih orbital nekje med:
predhodnimi p-orbitalami, ki imajo višjo energijo,
s-orbitalo, ki ima nižjo energijo.
Pri tem opazimo, da imamo še vedno eno p-orbitalo, ki je nismo uporabili pri tem postopku.
Tako razporejene orbitale lahko razložijo nastanek dvojne vezi v organskih molekulah. Nastanek dvojne vezi je podrobneje razložen v gradivu Vezi v ogljikovem atomu. Pri 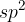 hibridizaciji tri elektrone razporedimo v hibridizirane orbitale, četrti pa se postavi v p-orbitalo.
hibridizaciji tri elektrone razporedimo v hibridizirane orbitale, četrti pa se postavi v p-orbitalo.
Torej ima 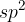 -hibridiziran ogljikov atom tri nove orbitale (slika 7), ki jih najbolje razporedimo v prostoru v trikotno-planarno obliko. To pomeni, da so vse hibridizirane orbitale na isti ravnini. Vsaka izmed treh orbital gleda svoje oglišče trikotnika:
-hibridiziran ogljikov atom tri nove orbitale (slika 7), ki jih najbolje razporedimo v prostoru v trikotno-planarno obliko. To pomeni, da so vse hibridizirane orbitale na isti ravnini. Vsaka izmed treh orbital gleda svoje oglišče trikotnika:
Pri tem ne smemo pozabiti na p-orbitalo, ki nam je ostala. Slednja je postavljena pravokotno na ravnino, na kateri ležijo hibridizirane orbitale. V tem primeru je oblika 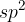 -hibridiziranega ogljikovega atoma približno taka:
-hibridiziranega ogljikovega atoma približno taka:
Vse hibridizirane orbitale ležijo na eni ravnini, p-orbitala pa izstopa iz ravnine - če bi hibridizirane orbitale ležale na tem ekranu, bi p-orbitala izstopala za in pred ekranom.
Pri 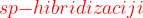 uporabimo:
uporabimo:
eno s-orbitalo,
eno p-orbitalo.
Uporabimo torej dve različni orbitali, ki ju preoblikujemo v dve enaki, hibridizirani orbitali. S pomočjo energetskega diagrama si poglejmo energijo hibridiziranih orbital:
Iz desnega diagrama po hibridizaciji (slika9) vidimo, da je energija novih orbital nekje med:
predhodnimi p-orbitalami, ki imajo višjo energijo,
s-orbitalo, ki ima nižjo energijo.
Pri tem opazimo, da imamo še vedno dve p-orbitali, ki ju pri tem postopku nismo uporabili. Tako energetsko razporejene orbitale lahko razložijo nastanek trojne vezi v organskih molekulah. Nastanek trojne vezi je podrobneje razložen v gradivu Vezi v ogljikovem atomu. Pri sp-hibridizaciji so elektroni razporejeni v:
dve hibridizirani orbitali
in dve p-orbitali.
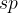 -hibridiziran ogljikov atom ima torej dve novi orbitali (slika 10), ki jih v prostoru najbolje razporedimo v linearno obliko. To pomeni, da sta hibridizirani orbitali na isti ravnini in postavljeni v ravno črto. Predstavljajmo si, da je ta ravnina naš ekran.
-hibridiziran ogljikov atom ima torej dve novi orbitali (slika 10), ki jih v prostoru najbolje razporedimo v linearno obliko. To pomeni, da sta hibridizirani orbitali na isti ravnini in postavljeni v ravno črto. Predstavljajmo si, da je ta ravnina naš ekran.
Pri tem ne smemo pozabiti na p-orbitali, ki sta še ostali. Ti dve pa gledata iz ravnine, na kateri ležijo hibridizirane orbitale. Zamislimo si, da izstopata iz ekrana. V tem primeru je oblika 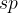 -hibridiziranega ogljikovega atoma približno taka:
-hibridiziranega ogljikovega atoma približno taka:
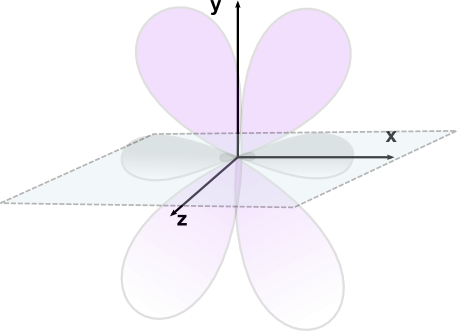
Slika 11: Struktura 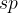 -hibridiziranega ogljikovega atoma (hibridizirane orbitale ležijo na ravnini xz,
-hibridiziranega ogljikovega atoma (hibridizirane orbitale ležijo na ravnini xz,
medtem pa p orbitali izstopata iz ravnine (ena leži na xy ravnini, druga pa na yz ravnini).
Hibridizacija je matematični postopek, pri katerem preoblikujemo različne orbitale atomov v nove oblike orbital. S tem lahko razložimo razporeditev in tvorbe vezi ogljikovega atoma. Ta lahko razporedi svoje valenčne elektrone v različne hibridizirane orbitale. Glede na to, katere hibridizirane orbitale uporabljajo ogljikovi atomi, so le-ti lahko:
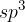 -hibridizirani
-hibridizirani
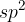 -hibridizirani
-hibridizirani
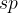 -hibridizirani
-hibridizirani