Osebne zbirke


Eliminacija je proces, pri katerem se iz organske spojine odstranijo manjše molekule. Eliminacije delimo na dve družini:
Eliminacije znotraj molekule
Pri tem procesu se atomi vezani na sosednja ogljika odcepijo iz molekule, nadomestijo jih nenasičene vezi (dvojna ali trojna vez):

Slika 1: Eliminacija znotraj molekule: iz organske molekule se odcepi manjša molekula ter nastane dvojna vez.
V tem gradivu bomo podrobneje spoznali eliminacije znotraj molekul, kot so:
dehidriranje (odcepitev vode),
dehalogeniranje (odcepitev halogenih elementov),
dehidrogenhalogeniranje (odcepitev vodikovih halogenidov).
Naštete reakcije so nasprotni procesi od adicije na nenasičene vezi:
Eliminacije med dvema molekulama
Pri tem procesu se atomi odcepijo iz dveh različnih molekul, molekuli pa se nato povežeta med seboj v novo in večjo molekulo.
Eliminacije med dvema molekulama sicer obravnavamo tudi v tem gradivu, a nekatere eliminacije zahtevajo več pozornosti, zato smo jih opisali v gradivih:
estrenje opisuje reakcije med karboksilnimi kislinami in alkoholi.
Dehidriranje je izraz za odcepitev molekule vode. Uporabljamo ga tako pri odcepu molekule vode iz ene molekule kot tudi, ko pride do odcepa vode med dvema molekulama.
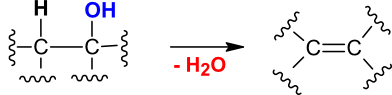
Slika 3: Eliminacija vode ali dehidracija: iz sosednjih atomov se odcepita vodik in hidroksilna skupina (OH).
Dehidriranje je reakcija značilna za alkohole, kjer se:
iz ogljikovega atoma odcepi hidroksilna skupina,
iz sosednjega ogljika pa vodikov atom.
Da reakcija poteče, moramo reakcijsko zmes:
segrevati
in ji dodati katalizator. Običajno je to kar kislina 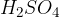 , ki je odličen katalizator; ima sposobnost, da veže vodo in s tem pospeši eliminacijo. Lahko pa uporabimo tudi
, ki je odličen katalizator; ima sposobnost, da veže vodo in s tem pospeši eliminacijo. Lahko pa uporabimo tudi 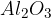 .
.
Oba pogoja, tako segrevanje (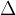 ) kot kislino, označimo na reakcijsko puščico z:
) kot kislino, označimo na reakcijsko puščico z:
Ko za katalizator uporabimo kislino, pa moramo biti pazljivi na temperaturo:
Pri temperaturah nad 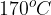 pride do intramolekularne eliminacije in nastane alken.
pride do intramolekularne eliminacije in nastane alken.
Pri temperaturah okrog 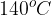 pa preferenčno poteče etrenje.
pa preferenčno poteče etrenje.
Pri eliminacijah pa lahko dobimo na koncu tudi zmes produktov. Zmes produktov nastane zato, ker se v spojinah tvorijo dvojne vezi na različnih pozicijah. Poglejmo si dva primera take eliminacije.
V zgornjem primeru lahko vidimo, da ne glede na to, kako bo prišlo do dehidracije, bo produkt vedno enak. To velja, ker je začetna spojina simetrična. Kaj pa če začetna spojina ni simetrična? Poglejmo si nasledni primer.
Do eliminacije lahko pride tudi, ko imamo na dveh sosednjih ogljikih halogena elementa. V tem primeru pride do tako imenovanega dehalogeniranja. Tudi to reakcijo kataliziramo in sicer s cinkom (Zn):
Pri dehalogeniranju:
nastane samo en produkt;
je stranski produkt eliminacije cinkov halogenid 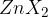 - kjer X predstavlja katerikoli halogeni element.
- kjer X predstavlja katerikoli halogeni element.
Dehidrogenhalogeniranje je eliminacija vodikovih halogenidov (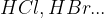 ). Eliminacije vodikovih halogenidov potekajo v bazični raztopini, pri tem kot katalizator lahko uporabimo:
). Eliminacije vodikovih halogenidov potekajo v bazični raztopini, pri tem kot katalizator lahko uporabimo:
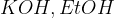 (raztopina kalijevega hidroksida v etanolu)
(raztopina kalijevega hidroksida v etanolu)
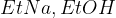 (raztopina natrijevega etoksida v etanolu)
(raztopina natrijevega etoksida v etanolu)
Shema reakcije je:
V primeru, da je halogeni element v molekuli vezan asimetrično, dobimo tudi tukaj - tako kot v gornjem poglavju o dehidriranju - na koncu zmesi produktov.