Osebne zbirke


Pri raztapljanju trdnih snovi pride do energetskih sprememb zaradi dveh procesov:
rušenja kristalne strukture;
hidratacije gradnikov.
Kristali so urejene strukture kristalnih enot (ioni, molekule, atomi...), ki se med seboj povežejo z naslednjimi vezmi:
molekulskimi (van der Waalsovimi),
Pri vzpostavljanju teh vezi se energija sprošča. In obratno: pri rušenju kristalne mreže moramo vložiti energijo. Proces rušenja kristalne strukture je zato endotermen proces.
Mrežna energija je energija, ki se sprosti pri procesu tvorbe 1mol trdne kristalizirane snovi iz prostih gradnikov v plinastem agregatnem stanju. Zato moramo, ko rušimo 1 mol kristalne mreže, vložiti energijo, ki je enaka ali večja mrežni energiji.
Hidratacija je proces, pri katerem pride do vezave molekul vode na gradnike nekega topljenca.
Na sliki 1 imamo primer hidratacije:
ionskega kristala, ki razpade na ionske gradnike (levo) in
molekulskega kristala, ki razpade na molekulske gradnike (desno).
Med molekulami vode in gradniki (ioni, molekule) se vzpostavijo šibke molekulske vezi. Pri tvorbi teh vezi se energija sprošča, kar pomeni, da je hidratacija eksotermen proces.
Hidratacija tako sprošča energijo, ki se nato porabi za dodatno rušenje kristalne mreže. Procesa rušenja kristalne mreže in hidratacije potekata istočasno in se med seboj dopolnjujeta.
Raztapljanje kristalov je lahko eksotermen ali endotermen proces. Entalpija raztapljanja je odvisna od:
vrednosti hidratacijske entalpije 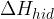
vrednosti mrežne entalpije 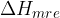
Poglejmo si energetsko shemo za raztapljanje kristalov:
Na energetski shemi imamo prikazane štiri primere:
Pri raztapljanju temperatura ostane enaka
Primer, ko pri raztapljanju ne opazimo spremembe v temperaturi raztopine, je na sliki obarvan črno. V tem primeru sta mrežna energija in hidratacijska energija povsem enaki:
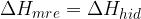
Količina energije, ki je potrebna za rušenje kristalne mreže, je natanko enaka energiji, ki se sprosti s hidratacijo delcev.
Pri raztapljanju se temperatura poveča
Primer, ko se pri raztapljanju raztopina segreje, je na sliki obarvan rdeče. V tem primeru je hidratacijska energija večja kot mrežna energija:

Količina energije, ki je potrebna za rušenje kristalne mreže, je manjša od energije, ki se sprosti s hidratacijo delcev. Reakcija je eksotermna, saj se odvečna energija pokaže v obliki sproščene toplote. Raztopina se segreje.
Pri raztapljanju se temperatura zmanjša
Primer, ko se pri raztapljanju raztopina ohladi, je na sliki obarvan modro. V tem primeru je sicer hidratacijska energija manjša od mrežne:

vendar pa sistem pobere potrebno energijo iz svoje okolice. Temperatura raztopine se zniža, raztopina se ohladi. Raztapljanje je v tem primeru endotermen proces.
Raztapljanje se ne zgodi
V tem primeru (na sliki zeleno obarvan) ne opazimo spremembe, oziroma kar s prostim očesom opazimo, da se kristal ne raztopi. Hidratacijska energija, ki bi sprožila razgradnjo kristala, je namreč premajhna:

Sistem ne zmore zagotoviti dovolj energije za rušenje mrežne strukture in zato ne pride do raztapljanja kristala.