Osebne zbirke


Galvanski člen je preprosta naprava, ki s pomočjo spontanih redoks procesov ustvarja enosmerni električni tok. Na osnovi galvanskega člena so narejene alkalijske baterije.
Najprej si poglejmo skico tipičnega galvanskega člena:
Opišimo galvanski člen na skici. Galvanski člen je sestavljen iz:
dveh polčlenov. Vsak polčlen sestavljata:
elektroda: pomembno je, da je elektroda narejena iz kateregakoli elektroprevodnega materiala (kovina, grafit, polprevodnik...). Elektrodi obeh polčlenov sta med seboj povezani z kovinsko žico, po kateri lahko potujejo elektroni.
elektrolit: elektrolit je raztopina ionov, ki prevajajo električni tok; na skici je označen z modro barvo, v kateri "plavajo" anioni (minusi) in kationi (plusi). Vsak polčlen ima drugačen elektrolit.
elektrolitskega ključa. Elektrolitski ključ je cevka, napolnjena z nasičeno raztopino elektrolita v gelu. Običajno v njem nastopata ali 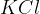 ali
ali 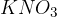 . Med delovanjem galvanskega člena omogoča pretok ionov.
. Med delovanjem galvanskega člena omogoča pretok ionov.
Za polčlena velja:
katoda je polčlen, ki ima bolj pozitiven elektrodni potencial; označimo jo s pozitivnim nabojem 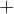 ;
;
anoda je polčlen, ki ima bolj negativen elektrodni potencial; označimo z negativnim nabojem  .
.
V poenostavljeni sliki galvanski člen deluje tako: elektroni potujejo od anode proti katodi po žici, ki povezuje elektrodi v posameznih polčlenih. Medtem pa anioni potujejo od katode proti anodi preko elektrolitskega ključa.
Redoks reakcije vedno potekajo v paru. Istočasno poteka tako redukcija kot oksidacija. V galvanskem členu potečejo te reakcije spontano zaradi razlike v elektrodnem potencijalu. Poglejmo podrobneje, kateri izmed procesov poteka v posameznih polčlenih.
Katoda je pozitivna nabita elektroda. To pomeni, da je njen elektrodni potencial v primerjavi z drugo elektrodo višji (bolj pozitiven). Pozitivnejši elektrodni potencial pa pomeni, da ioni v takem elektrolitu radi sprejemajo elektrone in se pretvorijo v elementarno obliko. Na katodi torej poteka redukcija.
Anoda je negativno nabita elektroda. To pomeni, da je njen elektrodni potencial nižji (negativnejši v primerajvo z elektrodo v drugem polčlenu). Negativnejši elektrodni potencial pomeni, da element raje odda elektrone in se pretvori v ionsko obliko. Na anodi torej poteka oksidacija.
Pojav najlažje razložimo na praktičnem primeru.
Za lažjo preglednost galvanskega člena je nastal tudi skrajšan in enostaven zapis galvanske celice. Za gornji primer bi diagram galvanske celice zapisali tako:
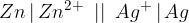
V poenostavljenem zapisu je redoks par, ki reagira na anodi, zapisan na levi strani. Vmes postavimo znak za elektrolitski ključ (||). Redoks par, ki reagira na katodi, zapišemo na desni strani.
Napetost galvanske celice izračunamo tako, da odštejemo potencial anode od potenciala katode. Pri tem mora biti izračunana napetost večja od 0.
Napetost galvanskega člena izračunamo z enačbo:
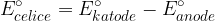
pri tem mora biti potencial večji od nič:
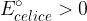
Na podlagi spoznanj galvanskega člena so narejene baterije in akumulatorji. Baterije in akumulatorji so naprave, ki vsebuje eno ali več elektrokemijskih celic. V takih napravah se shranjena kemijska energija pretvarja v električno.
Poznamo več vrst baterij:
primarne baterije, ki so baterije za enkratno uporabo;
sekundarne baterije, ki so baterije za večkratno uporabo. Pravimo jim tudi akumulatorji.
Take baterije lahko uporabimo samo enkrat in jih potem zavržemo. Med procesom proizvodnje električne energije pride do irreverzibilnih (neobnovljivih) kemijskih sprememb. Med primarnimi baterijami na tržišču prevladujejo:
alkalna,
cink-karbonska (Leclanchejeva),
živosrebrna,
srebrova baterija.
Akumulatorji so sekundarne baterije za večkratno uporabo. Akumulatorje v prvotno stanje obnovimo s pomočjo zunanjega električnega toka in ga ponovno uporabimo. Tako kot primarne baterije tudi akumulatorji tvorijo enosmerni tok. Najpogostejše sekundarne baterije so:
svinčeva,
nikelj-kadmijeva,
nikelj-metalhidridna,
litij-ionska.