Osebne zbirke


Soli so derivati, ki jih pridobimo, če zmešamo med sabo kisline in baze:
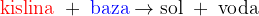
Sestavljene so iz:
Na sliki imamo predstavljeno sol in označeno, kateri deli pripadajo izhodni bazi kateri pa kislini.
Poimenovanje kationskega dela soli običajno ne predstavlja nikakršnih težav, saj navedemo samo kovino, ki ima vlogo kationa. Največkrat se nam zatakne pri poimenovanju anionskega dela, zato se bomo v nadaljevanju bolj posvečali tistemu delu soli, ki izhaja iz aniona.
Poimenovanje soli je odvisno od tipa soli:
enostavne soli, to so soli sestavljene iz dveh elementov, poimenujemo po pravilih za poimenovanje binarnih spojin,
soli, ki so sestavljene iz kompleksnejših anionov, pa obravnavamo nižje v gradivu.
Kot rečeno, je najtežji del poimenovanja tisti, ki izhaja iz anionskega dela soli. Ker anionski del poimenovanja izvira iz kislin, bomo pri nadaljni obravnavi določanja imen soli, ločeno obravnavali anione, ki izhajajo iz
binarnih kislin (kisline sestavljene iz vodikovih atomov in nekovine),
oksokislin (kisline sestavljene iz vodikovih atomov, centralne nekovine in kisika).
Poimenovanje soli, ki nastanejo iz binarnih kislin (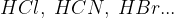 ), poteka po pravilih za poimenovanje binarnih spojin:
), poteka po pravilih za poimenovanje binarnih spojin:
Poimenujemo kation s slovenskim imenom in dodamo končnico -ev ali -ov.
Poimenujemo anion z latinskim imenom in dodamo končnico -id.
Slovenski del naziva soli je enostavno določljiv, zato se osredotočimo na latinski del imena. Navedimo nekatere najbolj pogoste latinske izraze za nekovinske anione, s katerimi si bomo pomagali pri določanju imen binarnih soli:
Opomba: pri navajanju latinskega imena v gornji tabeli smo si pomagali s konkretno kislino. Pri izpeljavi latinskega imena bi si prav tako lahko pomagali s katero drugo kislino - rezultat (latinsko poimenovanje) bi bil enak.
V gradivu Imenovanje kislin in baz smo spoznali, da dobijo oksokisline ime po centralnem atomu. Prav tako dobijo ime po centralnem atomu njihovi kislinski preostanki. Kislinski preostanek je anion, ki nastane, ko kislini poberemo proton. Anion dobi ime po svoji izvorni kislini in ga upoštevamo pri poimenovanju soli.
V spodnji tabeli so razvrščene najbolj uporabljene oksokisline in anioni, ki nastanejo iz njih. S pomočjo te tabele lahko razberemo imena posameznih anionov in njihove naboje:
Tudi poimenovanje soli iz oksokislin je podobno kot pri binarnih spojinah. Razlika je v tem, da so anioni sestavljeni iz več elementov (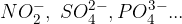 ) in jih torej obravnavamo v bloku. Postopek poimenovanja je:
) in jih torej obravnavamo v bloku. Postopek poimenovanja je:
Navedemo ime kovinskega kationa s slovensko osnovo.
Dodamo končnico -ev ali -ov.
Navedemo ime aniona, tako da vzamemo latinsko ime za centralni ion.
Dodamo končnico -at.
Navedemo oksidacijsko število centralnega atoma (v oklepaju z rimskimi števkami).
Ker so anioni iz oksokislin kompleksnejši (vsebujejo dva atoma), se velikokrat dogodi, da pride do zmede pri zapisovanju formule spojine.
Pri kovinah oksidativno stanje elementa sovpada z naboje ionov, ki jih tvorijo. Na primer:
oksidativno stanje aluminija je +3 (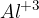 ), obenem pa
), obenem pa
aluminij tvori ione z nabojem 3+ (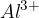 ).
).
Velja si zapomniti, da anione iz oksokislin obravnavamo v bloku. To pomeni, da jih upoštevamo kot da so ena enota - in temu primerno po potrebi spreminjamo število posamezni ionov. Za jasnejšo predstavo si poglejmo povedano na praktičnem primeru.
Hidrogen soli so soli, ki vsebujejo poleg nekovine in kisika tudi vodikov atom. Kisline, ki lahko tvorijo hidrogensoli so večprotonske kisline. Večprotonske kisline imajo več kot en vodikov atom in lahko protolizirajo po stopnjah. To pomeni, da postopoma oddajo posamezne vodikove atome. Pri tem nastanejo hidrogen anioni, ki tvorijo hidrogen soli. Ker se imena hidrogen soli tvorijo s pomočjo imen hidrogen anionov, nas zato tudi tukaj zanima poimenovanje hidrogen anionov.
Med predhodno obravnavanimi kislinami imamo tri skupine kislin, ki protolizirajo po stopnjah:
fosforjeva (V) kislina (ima tri vodike),
žveplovi kislini (imata po dva vodika),
ogljikova kislina (ima dva vodika).
Te kisline lahko tvorijo več različnih anionov (npr. fosforjeva kislina tvori 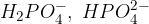 in
in 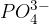 ). Ionom, ki nastanejo, dodamo besedo hidrogen kot predpono in z grškimi števniki povemo število vodikovih atomov.
). Ionom, ki nastanejo, dodamo besedo hidrogen kot predpono in z grškimi števniki povemo število vodikovih atomov.
Poglejmo si predstavnike posameznih večprotonskih kislin. V tabeli so izbrani predstavniki kislin, njihove formule in formule anionov, ki jih lahko tvorijo:
Kristalohidrati so soli, ki v točno določenem razmerju nase vežejo molekule vode, ki postanejo del kristalne strukture take soli. Ko zapišemo molekulsko formulo kristalohidrata, upoštevamo v imenu tudi molekule vode:
Poglejmo si sliko, na kateri je splošen primer kristalohidrata:
Opišimo sliko:
V kristalohidratu nastopata:
kobaltova sol,
voda, kjer je število vod zaradi splošnosti označeno z x. Običajno je število vod točno določeno.
v zapisu formule ločimo vodo od soli s piko.
Pri poimenovanju take soli, sledimo naslednjemu vrstnemu redu:
najprej zapišemo ime soli,
nato dodamo besedo hidrat,
s pomočjo grških števnikov povemo število vod in jih uporabimo kot predpono za besedo hidrat.
Poglejmo si primer poimenovanja kristalohidrata.
Če kristalohidrate segrevamo, lahko odstranimo vodo iz kristalne strukture. Brezvodna sol običajno ima drugačno barvo kot kristalohidrat.
Voda se sprosti iz kristalne strukture tudi, ko kristalohidrat raztopimo v vodi. Kristalna struktura se zruši in s tem se molekule vode sprostijo.
Pri anorganski kemiji se srečamo tudi s serijo ionov, ki sicer spadajo v območje organske kemije in bodo podrobneje obravnavani v gradivih o organski kemiji. Ti ioni nastanejo pri protolizi organskih kislin (ocetne kisline, mravljične kisline...). Ker nas zdaj ne zanimajo lastnosti teh kislin in njihovih anionov, jih bomo enostavno samo predstavili v spodnji tabeli.
Tabela vsebuje organske kisline in njihove anione, ki se uporabljajo tudi pri anorganski kemiji.
Soli iz teh ionov so dobro topne v vodi. Podobno kot pri poimenovanju binarnih spojin navedemo ime kovine in dodamo trivialno ime aniona.
Prav tako so dobro topne v vodi tudi soli z amonijevim ionom. Ta kation nastane s protolizo amonijaka:
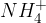
Amonijev ion je poseben, ker v svoji strukturi vsebuje dva različna elementa: vodik in dušik. Običajno imamo v soleh katione kovin ne pa nekovin. Poglejmo si na praktičnem primeru poimenovanje take soli.