Osebne zbirke


Nevtralizacija je kemijska reakcije, pri kateri reagirata baza in kislina. Produkta reakcije nevtralizacije sta sol in voda.

Pri nevtralizaciji reagirata baza, ki ima bazične lastnosti, in kislina, ki ima kisle lastnosti. Ker so kisle in bazične lastnosti nekako nasprotne, se pri reakciji nevtralizacije izničijo. Sol, ki nastane pri nevtralizaciji, je nevtralna - torej nima ne kislin in ne bazičnih lastnosti.
Značilnost nevtralizacije je še, da spada med eksotermne reakcije, pri katerih se sprošča toplota.
Reakcija nevtralizacije poteka v raztopini, kjer imamo v vodi raztopljeno bazo in kislino:
v raztopini baze imamo vedno ione kovin oziroma bazne preostanke in hidroksidne ione,
v raztopini kisline pa imamo anione oziroma kislinske preostanke in oksonijeve ione.
V raztopini baze in kisline so torej skupaj prisotni:
bazni preostanki,
hidroksidni ioni  ,
,
kislinski preostanki in
oksonijevi ioni 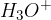 .
.
Med ioni potečeta 2 reakciji:
hidroksidni ioni in oksonijevi ioni se združijo v molekule vode,
bazni preostanki in kislinski preostanki pa tvorijo sol.
Najprej si poglejmo reakcijo med oksonijevimi in hidroksidnimi ioni. Oksonijev ion odda proton hidroksidnemu ionu. Iz oksonijevega iona nastane molekula vode, in tudi in hidroksidnega iona nastane molekula vode:
Poglejmo zgornjo sliko:
Na levi strani slike sta prikazana oksonijev ion (atom kisika, ki ga obdajajo 3 atomi vodika) in hidroksidni ion (atom kisika in atom vodika). Oksonijev ion odda hidroksidnemu ionu en atom vodika oziroma proton.
Na desni strani imamo prikazana produkta reakcije. Iz oksonijevega iona nastane molekula vode. Tudi iz hidroksidnega iona nastane molekula vode.
Reakcijo med oksonijevimi ioni in hidroksidnimi ioni zapišemo:
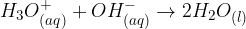
Bazni preostanek in kislinski preostanek pa se združita v sol. Soli so običajno dobro topne v vodi, zato je sol po koncu reakcije v raztopini prisotna v obliki raztopljenih kovinskih ionov in kislinskih preostankov.
Če pa bi po koncu kemijske reakcije odstranili nastale molekule vode in tudi že prej prisotne molekule vode tako, da bi vodo izparili, bi se ioni kovin in kislinski preostanki povezali in nastali bi kristali soli.
Ko zapisujemo reakcijo nevtralizacije, kot reaktanta zapišemo le bazo in kislino, ne pa baznih in kislinskih preostankov ter hidroksilnih in oksonijevih ionov. Reakcijo torej zapišemo poenostavljeno.
Pri poenostavljenem zapisu reakcije privzamemo, da kislina in baza v raztopini nista v ionski obliki:
torej baza ne razpade na kovinske ione in hidroksidne ione in
iz kisline ne nastanejo oksonijevi ioni in kislinski preostanki.
Namesto tega predpostavimo, da sta kislina in baza v raztopini prisotni v obliki molekul in takoj reagirata med sabo, pri čemer kislina odda proton bazi. Ta poenostavitev nam omogoča, da reakcijo zapišemo bolj pregledno in enostavno.
Med baze spadajo kovinski hidroksidi in amonijak. V primeru, ko imamo bazo amonijak, reakcijo nevtralizacije zapišemo nekoliko drugače.
Kovinski hidroksidi imajo v svoji formuli hidroksdine ione  . Ko kislina odda proton bazi, iz hidrokdinega iona in protona nastane molekula vode.
. Ko kislina odda proton bazi, iz hidrokdinega iona in protona nastane molekula vode.
Amonijak pa ima molekulsko formulo  in ni sestavljen iz hidroksidnih ionov, ampak hidroksidne ione tvori šele z vodo v raztopini. Hidroksidni ioni so nujni za nastanek vode pri nevtralizaciji.
in ni sestavljen iz hidroksidnih ionov, ampak hidroksidne ione tvori šele z vodo v raztopini. Hidroksidni ioni so nujni za nastanek vode pri nevtralizaciji.
Tudi reakcijo amonijaka s kislinami zapišemo poenostavljeno. Pri tem kot reaktant zapišemo le bazo amonijaka, ne pa tudi hidroksidnih ionov. Vode zato ne zapišemo kot produkta reakcije, zapišemo le nastalo sol.
Pri reakciji amonijaka s kislino kot produkt zapišemo le nastalo sol.