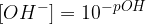Osebne zbirke


pH indikator označuje koncentracijo oksonijevih ionov 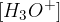 v dani raztopini. To je merilo, ki nam pomaga opredeliti, ali je naša vodna raztopina:
v dani raztopini. To je merilo, ki nam pomaga opredeliti, ali je naša vodna raztopina:
nevtralna.
A predno pH merilo natančneje opredelimo, najprej spoznajmo obnašanje vode. Že v gradivu Protolitske reakcije smo opazili, da lahko voda protone tako oddaja kot tudi prejema.
Čista, destilirana, voda je slab elektrolit, ker je koncentracija ionov v čisti vodi izredno majhna. Le majhen delež molekul vode disociira na:
oksonijeve 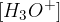 ione
ione
hidroksidne 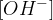 ione.
ione.
Reakcija, ki poteče, je sledeča:
Shema reakcije prikazuje, kako:
ena molekula vode odda proton 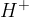 ,
,
ena molekula pa sprejme proton 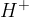 .
.
Reakcijo, pri kateri ena molekula vode odda drugi proton, imenujemo avtoprotoliza vode. Koncentracija oksonijevih in hidroksidnih ionov je enaka:
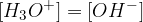
To je razumljivo, saj toliko molekul kot odda svoj proton, toliko molekul oddani proton tudi sprejme.
Ker je avtoprotoliza vode ravnotežna reakcija, lahko zanjo zapišemo konstanto:
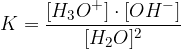
Ker ima voda konstantno koncentracijo, lahko z njo pomnožimo enačbo in dobimo ionski produkt vode:
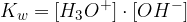
Ionski produkt vode 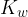 povezuje koncentracijo
povezuje koncentracijo 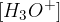 in
in 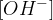 ionov v vseh vodnih raztopinah. Pri tem je nepomembno, kakšna je vodna raztopina (bazična, kisla ali nevtralna); ionski produkt vode je v vsaki vodni raztopini enak.
ionov v vseh vodnih raztopinah. Pri tem je nepomembno, kakšna je vodna raztopina (bazična, kisla ali nevtralna); ionski produkt vode je v vsaki vodni raztopini enak.
Ionski produkt vode je merilo za koncentracijo oksonijevih in hidroksidnih ionov v vodnih raztopinah. Njegova vrednost je pri 25°C:
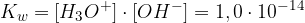
Kot vse konstante ravnotežja tudi za ionski produkt vode ne zapisujemo enot.
Raztopine so mešanica ionov posameznih ionskih spojin in vode. Zaradi vplivov spojin, ki so dodane v vodo, se koncentracije oksonijevih in hidroksidnih ionov v različnih vodnih raztopinah spreminjajo. Glede na to, kateri izmed ionov prevladuje, lahko opredelimo kislost ali bazičnost dane raztopine. Velja:
V čisti vodi je koncentracija obeh ionov 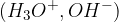 enaka, zato je voda nevtralna. Iz ionskega produkta vode lahko izračunamo dejansko koncentracijo posameznih ionov.
enaka, zato je voda nevtralna. Iz ionskega produkta vode lahko izračunamo dejansko koncentracijo posameznih ionov.
Ko govorimo o nevtralnih raztopinah, imamo v mislih, da sta koncentraciji ionov enaki in znašata 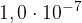 . Pri kislinah prevladujejo oksonijevi ioni, posledično imajo kisle raztopine sledeče koncentracije:
. Pri kislinah prevladujejo oksonijevi ioni, posledično imajo kisle raztopine sledeče koncentracije:
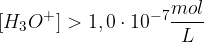
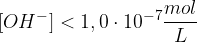
Poglejmo si na praktičnem primeru trditvi o koncentracijah.
Tudi pri raztopinah šibkih kislin prevladujejo oksonijevi ioni, vendar pa njihova koncentracija ni enaka koncentraciji kisline. Šibke kisline le delno disociirajo na oksonijeve ione in kislinski preostanek. Koncentracijo oksonijevih ionov lahko določimo samo, če poznamo konstanto kisline 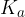 .
.
Koncentracija oksonijevih ionov za šibko kislino se glasi:
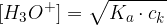
Poglejmo na praktičnem primeru, kako pridemo do enačbe za koncentracijo oksonijevih ionov za šibko kislino.
Podoben princip, kot velja za kisline, velja tudi za baze. Če v nevtralnih raztopinah sta koncentraciji ionov enaki,za baze velja, da prevladujejo hidroksidni ioni. Koncentracije posameznih ionov v alkalnih raztopinah so:
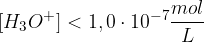
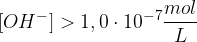
Poglejmo si na praktičnem primeru trditvi o koncentracijah.
Tudi pri šibkih bazah velja, da koncentracija hidroksidnih ionov ni enaka koncentraciji baze, ker le-ta delno disociira na hidroksidne ione in bazni preostanek. Tudi v tem primeru koncentracijo hidroksidnih ionov lahko izračunamo, če poznamo konstanto baze 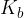 .
.
Torej koncentracijo hidroksidnih ionov za šibko bazo se glasi:
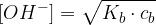
Poglejmo na praktičnem primeru, kako pridemo do enačbe za koncentracijo oksonijevih ionov za šibko kislino.
Vse vrednosti pH posameznih raztopin so združene v pH lestvico z merilom od 0 pa do 14. pH lestvica je dejansko merilo koncentracije oksonijevih ionov in sicer velja: čim višja je koncentracija le-teh, tem manjši je pH raztopine.
Na tej lestvici imamo tri območja:
nevtralno območje s točno vrednostjo 7,
Na pH vrednost vpliva:
Koncentracija
višja je koncentracija kisline, nižji je pH,
višja je koncentracija baze, višji je pH.
Moč
močna kislina pH premaknjen proti 0,
šibka kislina pH bliže 7 (pod 7),
močna baza pH premaknjen proti 14,
šibka baza pH bliže 7 (nad 7).
To so snovi, ki spremenijo barvo glede na kislost ali bazičnost raztopin. Največkrat uporabljeni pH indikatorji so:
lakmusov papir,
metiloranž,
fenolftalein.
Barva pH indikatorjev se postopno spreminja ter s tem nakazuje kislost ali bazičnost. Pri skrajnih pH vrednostih velja:
S pomočjo barvnih indikatorjev določimo kislost ali bazičnost raztopin le v grobem. Za natančnejše meritve se uporablja pH metre. To so naprave, ki merijo aktivnost oksonijevih ionov v raztopini.
Če poznamo koncentracijo oksonijevih ionov v raztopini, lahko pH tudi izračunamo.
Število pH je negativni desetiški logaritem koncentracije oksonijevih ionov. Izračunamo ga z enačbo:
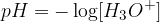
Poglejmo si primer računanja pH števila za vodno raztopino klorovodikove kisline.
Podobno velja v primeru baz. Če poznamo koncentracijo hidroksidnih ionov, lahko izračunamo pOH.
Število pOH je negativni desetiški logaritem koncentracije hidroksidnih ionov. Izračunamo ga z enačbo:
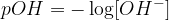
pH in pOH sta tesno povezana: če poznamo enega, poznamo tudi drugega. Enačba, ki povezuje pH in pOH, je izpeljana iz ionskega produkta vode. Na tem mestu njene izpeljave ne bomo navajali, zapišimo le ugotovitev:
Enačba, ki povezuje pH in pOH se glasi:
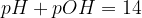
Vemo, da iz koncentracije oksonijevih ionov lahko izračunamo pH, iz hidroksidnih pa pOH. Postopek pa lahko tudi obrnemo: če poznamo pH ali pOH, lahko izračunamo koncentracijo ionov, iz njih pa sklepamo na koncentracijo kisline ali baze.
Enačba za izračun koncentracije oksonijevih ionov iz pH je:
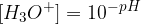
Enačba za izračun koncentracije hidroksidnih ionov iz pOH je: