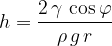Osebne zbirke


Površinsko napetost opazujemo na meji med kapljevino in plinom. Površinska napetost je tisti pojav, ki povzroči, da se površina kapljevine obnaša kot napeta opna, na katero lahko položimo lahek predmet - in predmet obstane na površini (glej sliko 1). Pri tem sila vzgona ni vpletena, saj je gostota telesa lahko večja od gostote tekočine.
Površinska napetost opazimo, če kapljevina miruje pri nižjih temperaturah. Termično gibanje molekul pri višjih temperaturah slabijo pojav površinske napetosti.
Videli bomo, da so vzrok za površinsko napetost šibke privlačne medmolekularne sile v kapljevinah. Imenujejo se Van der Waalsove sile. Te so na površini razporejene drugače kot v globini. Delujejo tangencialno na gladino tako, da jo napenjajo. Če se tekočina vboči zaradi delovanja sile teže (glej sliko 1 in 2), deluje sila površinske napetosti tangencialno na krivino gladine in jo želi izravnati.
Med molekulami kapljevine delujejo medmolekularne sile. Sile med molekulami smo spoznali že v poglavju Deformacija trdnin. Če je razdalja med molekulami:
večja od radija molekule, so sile privlačne,
manjša od radija molekule, pa odbojne. Ker je kapljevina skoraj nestisljiva, odbojna sila pri 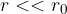 strmo narašča.
strmo narašča.
Opazujmo molekulo vode dovolj globoko pod površino. Vzemimo, da je v začetku razdalja sosednje molekule od opazovane veliko večja od radija molekule:
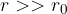
Smatrajmo, da je pri tej razdalji potencialna energija molekule enaka nič. Spomnimo: sami lahko poljubno določimo, kje bo potencialna energija nič. Zaradi privlačne sile F se molekula približa opazovani molekuli do razdalje 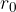 . Njena potencialna energija pada, postaja negativna. Pri razdalji
. Njena potencialna energija pada, postaja negativna. Pri razdalji 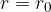 doseže maksimalno negativno vrednost
doseže maksimalno negativno vrednost 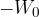 (glej sliko 3).
(glej sliko 3).
Privlačne sile med molekulami v kapljevinah imajo kratek doseg. Njeni vplivi se raztezajo le do razdalje nekajkratnika radija molekule. Vzemimo, da le N sosednjih molekul prispeva k potencialni energiji. Skupna potencialna energije je:
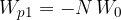
Na molekulo, ki se nahaja na površini, deluje polovico manj sosednjih molekul, zato je njena potencialna energija polovico manjša (glej sliko 4):
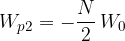
Razlika med potencialno energijo molekulo na površini in pod gladino je:
Potencialna energija molekule na površini je večja od potencialne energije molekule pod površino!
Vrnimo se k pojavu, ko gladina vode preseže rob kozarca. Opazimo lahko, da je površina gladine večja, kot pa je presek kozarca - površina gladine je namreč zaobljena. Ker je površina gladine večja od preseka kozarca, to pomeni, da smo morali na površino dovesti dodatne molekule.
Če si računanje poenostavimo, lahko rečemo, da je površina ene molekule 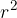 in število molekul, ki jih moramo dovesti na površino, da jo povečamo za
in število molekul, ki jih moramo dovesti na površino, da jo povečamo za 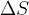 , enaka:
, enaka:
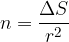
Na površino smo dovedli n dodatnih molekul, zato se skupna potencialna energija poveča za:
Da povečamo površino gladine, moramo premestiti notranje molekule na površino. Za to potrebujemo energijo. Sprememba površinske energije je sorazmerna spremembi površine. Faktor sorazmernosti je površinska napetost 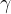 :
:
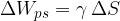
Vzemimo okvir z gibljivo prečko dolžine l. Okvir pomočimo npr. v milnico tako, da se preko celotne površine naredi opna. Če na prečko ne deluje nobena sila, jo želi opna premakniti v smeri zmanjšanja skupne površine. Na prečko delujmo s silo F tako, da jo premaknemo za 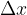 (glej sliko 5). Skupna površina opne milnice se poveča za
(glej sliko 5). Skupna površina opne milnice se poveča za 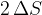 . Faktor 2 smo vzeli zato, ker ima opna dejansko dvojno mejno površino glede na zrak.
. Faktor 2 smo vzeli zato, ker ima opna dejansko dvojno mejno površino glede na zrak.
Če želimo povečati skupno površino za 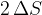 , moramo opraviti delo A, ki je enako spremembi potencialne energije površine kapljevine:
, moramo opraviti delo A, ki je enako spremembi potencialne energije površine kapljevine:
V spodnji tabeli so podane površinske napetosti izbranih kapljevin.
Površinska napetost nam pove, koliko dela moramo opraviti, da povečamo površino kapljevine za 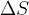 :
:
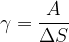
Enota je:
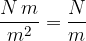
Sila površinske napetosti je usmerjena tangencialno na površino in deluje v smeri zmanjšanja površine. Izračunamo jo s pomočjo enačbe:
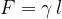
Tu je l dolžina mejnega roba tekočine. Če opna tekočine na obeh straneh meji na zrak, moramo vzeti dvojno dolžino l:
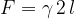
V prejšnjem poglavju smo se omejili na fenomen površinske napetosti ob stiku kapljevina - plin (zrak). Obstajajo pa tudi druge mejne površine, na katerih nastaja površinska napetost. To sta poleg kapljevine in plina tudi meja med:
trdnino in kapljevino ter
trdnino in plinom.
Vse tri površinske napetosti vplivajo na obliko ploskve kapljevine ob stiku s trdnino in plinom.
Kakšna kapljica tekočine nastane je odvisno od površinske napetosti na vseh ploskvah, ki mejijo na kapljico. Za razlago tega pojava pojem površinske napetosti razširimo na površinsko napetost med dvema snovema, npr. kapljevino in zrakom, kapljevino in trdnino, med trdnino in zrakom ali pa med dvema kapljevinama.
Zakaj pride do površinske napetosti ob stikih različnih snovi istih ali različnih faz (trdnin, tekočin, plinov)?
Kvalitativna razlaga, zakaj pride do površinske napetosti med kapljevino in plinom je bila v začetku snovi podana na osnovi spremembe potencialne energije, ki jo povzročajo šibke Van der Waalsove sile. Delujejo privlačno in molekule, ko se zbližajo v gruče, zgubljajo potencialno energijo. Videli smo, da je padec potencialne energije odvisen od tega, ali opazujemo molekule znotraj snovi ali pa na meji s plinom (npr. zrakom).
Podobno delujejo šibke sile tudi na stiku poljubnih dveh snovi istih ali različnih faz. Potencialna energija je drugačna v znotraj snovi, kot na njeni mejni ploskvi. In odvisna je od obeh snovi, ki se stikata.
Vrnimo se na kapljico. Tekočina zavzame takšno obliko, da ima najmanjšo skupno energijo. Ta je sestavljena iz površinske energije in potencialne energije zaradi teže. Če zanemarimo potencialno energijo zaradi teže, je najugodnejša oblika kroglica. Ima najmanjšo površino pri danem volumnu. Če je kapljica velika, se nekoliko splošči, težišče (potencialna energija) se ji zniža. Skupna energija je še vedno najmanjša. Pravimo, da je tekočina v stabilnem ravnovesnem stanju.
Na stični črti plin - tekočina - trdnina (podlaga) obstajajo tri površinska napetost (glej sliko 9):
Površinska napetost med kapljevino in plinom: 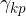
Površinska napetost med kapljevino in trdnino 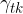
Površinska napetost med trdnino in plinom 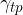
Horizontalne komponente sil na rob kapljice se morajo izničiti, da kapljica miruje. Iz tega pogoja izrazimo kot, ki ga oklepa kapljica s podlago.
V tabeli so podani izbrani koti omočitve za nekatere trdnine in kapljevine:
Kot 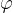 določa omočitev (glej sliko 10). Če je kot omočitve manjši od
določa omočitev (glej sliko 10). Če je kot omočitve manjši od 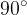 , se podlaga omoči. Če je večji od
, se podlaga omoči. Če je večji od 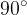 , se podlaga ne omoči. Mejni kot med omočeno ali neomočeno podlago pa je
, se podlaga ne omoči. Mejni kot med omočeno ali neomočeno podlago pa je 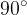 .
.
Kot omočitve se imenuje kot med površino kapljice in podlage. Če je kot omočitve manjši od 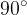 , se podlaga omoči. Če je večji od
, se podlaga omoči. Če je večji od 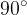 , se podlaga ne omoči.
, se podlaga ne omoči.
V uvodu smo omenili, da lahko potuje tekočina, npr. voda po tankih ceveh imenovanih kapilare, navzgor, ne da bi bila zo to potrebna dodatna sila ali tlak. Kapilare v rastlinah omogočajo, da doseže voda od korenin vse njene dele. Pojavu pravimo kapilarni tlak in je posledica površinske napetosti.
Kapilarni tlak je odvisen od kota omočitve med steno kapilare in tekočino. Če je kot omočitve manjši od 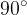 , se tekočina dvigne po cevi nad gladino, če je večji, je gladina v kapilari nižja.
, se tekočina dvigne po cevi nad gladino, če je večji, je gladina v kapilari nižja.
Kako izračunamo dvig tekočine v kapilari? Pomagajmo si s sliko 11:
Vertikalna komponenta sile površinske napetosti je nasprotno enaka sili teže tekočine v kapilari:
Za koliko se kapljevine dvigne ali spusti po kapilari ja odvisno od viskoznosti kapljevine, kota močenja med kapljevino in snovjo, iz katere je kapilara, gostote kapljevine in polmera kapilare: