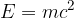Osebne zbirke


Atomsko jedro je del atoma. Predstavljamo si ga lahko kot kroglico v kateri so tesno skupaj nagneteni protoni in nevtroni. Poglejmo si ga podrobneje.
Delce, ki sestavljajo atome smo že opisali v gradivu Sestavni deli atoma, na tem mestu naredimo le kratek povzetek. Atomi so sestavljeni iz:
protonov, katerih število označimo z Z in mu rečemo vrstno število
nevtronov, katerih število označimo z N
ter elektronov
Število protonov in nevtronov v jedru imenujemo masno število in ga označimo z oznako A. Pove nam približno maso (težo) jedra. Na sliki 1 je prikazan standardni zapis (kemijskega) elementa s podatkoma o masnem in vrstnem številu:
Vrstno število Z nam pove število protonov v jedru, masno število A pa število nevtronov in protonov v jedru.
Ocena polmera jedra je premosorazmerna s tretjim korenom masnega števila (torej števila protonov in nevtronov):

Jedra z enakim številom protonov in različnim številom nevtronov imenujemo izotope.
Izotopi določenega elementa imajo zelo podobne kemične lastnosti, saj so te lastnosti določene predvsem z razporeditvijo in številom in elektronov (ki je enako številu protonov). Izotopi se tako med seboj razlikujejo predvsem po masi (torej po masnem številu A), ki pa v večini kemijskih reakcij nima posebnega vpliva. Število nevtronov ima močan vpliv na dogajanje v samih jedrih, predvsem na njihovo stabilnost.
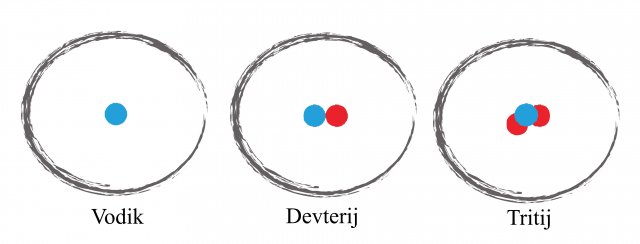
Slika 2: izotopi vodika imajo zaradi pomembnosti lastna imena. Jedro z enim protonom in enim nevtronom imenujemo devterij, jedro z dvema nevtronoma in protonom pa tritij.
Izotopi danega elementa se razlikujejo v številu nevtronov.
Relativna atomska masa elementa 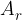 ki je v periodnem sistemu včasih navedena poleg vsakega elementa, je povprečna masa različnih izotopov tega elementa ki se pojavljajo v naravi. Pri odčitavanju
ki je v periodnem sistemu včasih navedena poleg vsakega elementa, je povprečna masa različnih izotopov tega elementa ki se pojavljajo v naravi. Pri odčitavanju  s periodnega sistema elementov moramo biti pozorni, saj je
s periodnega sistema elementov moramo biti pozorni, saj je 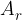 dostikrat označena samo kot A, zaradi česar jo hitro lahko zamenjamo z masnim številom A.
dostikrat označena samo kot A, zaradi česar jo hitro lahko zamenjamo z masnim številom A. 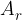 izračunamo z enačbo:
izračunamo z enačbo:
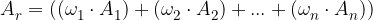
kjer so 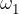 ,
,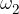 ,...,
,...,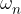 deleži posameznih izotopov elementa v naravi, A-ji pa njihova masna števila.
deleži posameznih izotopov elementa v naravi, A-ji pa njihova masna števila.
V jedru so na majhnem prostoru stisnjeni vsi protoni. In čeprav se pozitivno nabiti protoni (električno) med seboj odbijajo, jedro ne razpade. Razlog, da jedro ne razpade je, da med nukleoni delujejo močne in privlačne jedrske sile.
Če bi želeli jedro razbiti na posamične proste protone in nevtrone, bi potrebovali energijo, ki bi morala biti večja od vezavne energije jedra. Velikost te energije se med jedri razlikuje. Večja kot je vezavna energija, težje je jedro razbiti in posledično so taka jedra bolj stabilna.
Če vezavno energijo delimo s število nukleonov, dobimo povprečno energijo, s katero je na jedro vezan posamični nukleon. Tej energiji pravimo specifična vezavna energija in je merilo za stabilnost jedra. Jedra z večjo specifično vezavno energijo so stabilnejša od jeder z manjšo.
Vezavna energija jedra je energija, ki bi jo bilo potrebno dovesti, da bi jedro razcepili na proste protone in nevtrone.
Specifična vezavna energija jedra je povprečna energija s katero so v jedro vezani posamični nukleoni.
Na naslednji sliki je prikazan graf specifičnih vezavnih energij za različne nukleone:
Iz grafa lahko razberemo, da specifična vezavna energija - ko se premikamo od lažjih jeder proti težjim - najprej narašča, doseže svoj vrh pri jedrih okoli niklja in železa, nato pa, ko se začnemo premikati proti težjim jedrom, začne padati.
Vezavno energijo jeder ugotovimo s pomočjo masnega defekta jeder. Če izmerimo maso:
prostih protonov in nevtronov in
jedra iz enakega števila protonov in nevtronov
ugotovimo, da je masa jedra manjša od vsote mas prostih protonov in nevtronov. To razliko v masah imenujemo masni defekt.
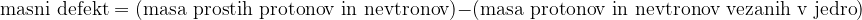
Z enačbo to zapišemo kot
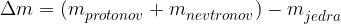
To dejstvo krši zakon o ohranitve mase, ki je eden osnovnih zakonov klasične fizike. A v jedrski fiziki ta ohranitveni zakon ne velja. Kaj se zgodi?
Sprememba mase je povezana z energijo, ki se pri reakciji sprosti ali porabi. Spreminjanje mase v energijo in obratno opisuje enačba:
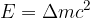
kjer je  svetlobna hitrost. To je slovita Einsteinova energijska enačba.
svetlobna hitrost. To je slovita Einsteinova energijska enačba.
Masni defekt jedra je torej masa, ki se pretvori v vezavno energijo jedra. Zato je jedro lažje od prostih protonov in nevtronov. To je hkrati tudi energija, ki jo je potrebno dovesti, če želimo jedro spet razcepiti.
Masa jedra ni enaka seštevku mas protonov in nevtronov, ki jedro sestavljajo. Tako razliko mas imenujemo masni defekt. Masni defekt razložimo s pomočjo Einsteinova energijske enačbe: