Osebne zbirke


V gradivu Ogljikove spojine smo spoznali, da lahko ogljik tvori različne spojine, ki so po večini sestavljene iz ogljika in vodika. Vendar pa je svet organske kemije obsežnejši, zato med organske spojine uvrščamo tudi spojine, ki poleg ogljika vsebujejo še druge ključne atome.
V tem poglavju bomo spoznali dokazne reakcije za najpogostejše elemente, ki jih najdemo v takih spojinah. To so (kvalitativne) reakcije, pri katerih določamo samo prisotnost nekega elementa. Ne pa določamo pa tudi njegove množine oziroma količine (kvantitete). Iz teh reakcij se bomo naučili določati elementno sestavo spojin.
Spoznali bomo dokazne reakcije za:
ogljik,
vodik,
halogene elemente,
dušik,
žveplo.
Ogljik v organskih spojinah dokazujemo posredno. To pomeni, da ga najprej pretvorimo v drugo obliko in dokazujemo to novo molekulo. Najprej si oglejmo laboratorijsko orodje, ki ga potrebujemo za to dokazno reakcijo.
Opišimo sliko:
Na sliki imamo epruveto, v kateri se nahaja naša organska snov.
Epruveta in preostali sistem je fiksiran s pomočjo stojala.
Epruveto nastavimo nad plamen zato, da poteče pretvorba.
Novo nastale spojine, gredo nad reagentom 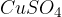 , kjer poteče prva reakcija (ki bo opisana v nadaljevanju).
, kjer poteče prva reakcija (ki bo opisana v nadaljevanju).
Preostanek izhaja v obliki mehurčkov 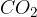 .
.
Mehurčki so speljani skozi apnico, kjer poteče druga reakcija (ki bo opisana v nadaljevanju).
Najprej bomo opisali dokazno reakcijo za ogljik. Če želimo dokazati ogljik, ga moramo najprej pretvoriti v ogljikov dioksid 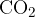 . Pretvorba poteče tako, da organsko spojino oksidiramo ob prisotnosti bakrovega (II) oksida
. Pretvorba poteče tako, da organsko spojino oksidiramo ob prisotnosti bakrovega (II) oksida 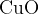 (slika aparature; slika 1). Pri tej reakciji se ogljik poveže s kisikom:
(slika aparature; slika 1). Pri tej reakciji se ogljik poveže s kisikom:
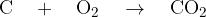
Spomnimo se, ogljikov dioksid je plin, ki ga pri tej reakciji ulovimo in usmerimo skozi apnico (raztopino kalcijevega hidroksida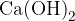 ). Ko pride ogljikov dioksid v stik z apnico poteče naslednja reakcija:
). Ko pride ogljikov dioksid v stik z apnico poteče naslednja reakcija:
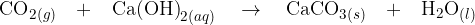
Ko poteče reakcija, prej brezbarvna raztopina postane motna zaradi nastanka netopnega kalcijevega karbonata 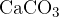 .
.
Tudi vodik dokazujemo posredno. Reakcija pretvorbe poteče istočasno s pretvorbo ogljika (glej slika 1).
Če želimo dokazati vodik, ga najprej pretvorimo v vodo 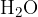 . Pretvorba poteče tako, da organsko spojino oksidiramo ob prisotnosti bakrovega (II) oksida
. Pretvorba poteče tako, da organsko spojino oksidiramo ob prisotnosti bakrovega (II) oksida 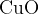 . Pri tej reakciji se vodik poveže s kisikom:
. Pri tej reakciji se vodik poveže s kisikom:

V tem primeru pri reakciji nastaja para, ki na stenah epruvete kondenzira. Novo nastala voda pride v stik z belim bakrovim sulfatom (VI) 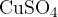 . Poteče naslednja reakcija:
. Poteče naslednja reakcija:
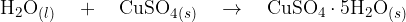
Ko poteče reakcija, se prej bel brezvodni bakrov (II) sulfat (VI) obarva modro. Modro obarvanje je posledica nastanka kristalohidrata 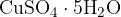 . Bakrov (II) sulfat (VI) pentahidrat poznamo tudi pod imenom modra galica.
. Bakrov (II) sulfat (VI) pentahidrat poznamo tudi pod imenom modra galica.
Halogeni elementi so atomi VII. skupine periodnega sistema. V organskih spojinah najpogosteje najdemo in dokazujemo naslednje halogene elemente:
klor,
brom,
jod.
Te atome dokazujemo z dvema reakcijama, ki ju bomo tudi spoznali:
dokaz halogenov s srebrovim (I) nitratom (V) 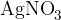 ,
,
dokaz halogenov z Bielsteinovo reakcijo.
Pri dokazovanju halogenih elementov moramo organske molekule najprej razstavit na osnovne elemente in njihove ione. Postopek, s katerim to dosežemo, imenujemo razklop.
Razklop je reakcija, s katero molekule razstavimo na njihove elemente in ione.
V primeru halogenov opravimo razklop v prisotnosti natrija 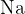 . Pri čemer dobimo naslednje ione:
. Pri čemer dobimo naslednje ione:
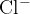 ,
,
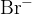 ,
,
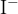 .
.
V raztopino novo nastalih ionov dodamo raztopino srebrovega nitrata. Pri tem potečejo sledeče reakcije:
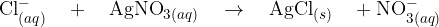
Pri dodatku srebrovega nitrata pride do ionske reakcije, kjer nastane slabo topen srebrov (I) klorid 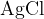 . Oborina je v tem primeru obarvana belo.
. Oborina je v tem primeru obarvana belo.
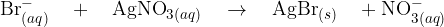
Pri tem pride do ionske reakcije, kjer nastane slabo topen srebrov (I) bromid 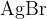 . Oborina je v tem primeru obarvana svetlo rumeno.
. Oborina je v tem primeru obarvana svetlo rumeno.
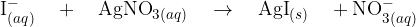
Pri tem pride do ionske reakcije, kjer nastane slabo topen srebrov (I) jodid 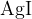 . Oborina je v tem primeru obarvana intenzivno rumeno.
. Oborina je v tem primeru obarvana intenzivno rumeno.
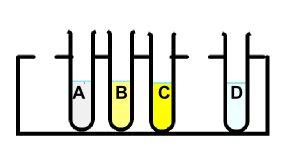
Slika 2: Reakcija halidov s srebrovim nitratom; barvna primerjava A) jodid B) bromid C) klorid D) samo srebrov klorid.
Slika 2 prikazuje barvno razliko med posameznimi oborinami, ko sprožimo reakcijo med halidi (jodid, bromid, klorid) in srebrovim nitratom:
epruveta A: reakcija z jodidom nam spremeni brezbarvni srebrov nitrat v intenzivno rumeno raztopino;
epruveta B: reakcija z bromidom nam poda nežno rumeno obarvanje;
epruveta C: reakcija s kloridom raztopino obarva belo;
epruveta D: srebrov nitrat je brezbarven, ta epruveta je samo za primerjavo.
Beilsteinova reakcija spada pod plamenske reakcije. Pri plamenskih reakcijah vzorec izpostavimo v direkten stik s plamenom gorilnika (glej sliko), pri čemer se plamen obarva.
V našem primeru najprej bakreno žico 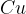 prežarimo nad ognjem. Poteče sledeča reakcija:
prežarimo nad ognjem. Poteče sledeča reakcija:
besediloV reakciji se pojavi simbol 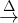 , kar pomeni reakcija z gorenjem/plamenom.
, kar pomeni reakcija z gorenjem/plamenom.
Z prežarjeno žico, na kateri je bakrov (II) oksid 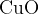 , zajamemo delček našega vzorčka in ga ponovno izpostavimo ognju. Najprej poteče reakcija med našo spojino (
, zajamemo delček našega vzorčka in ga ponovno izpostavimo ognju. Najprej poteče reakcija med našo spojino (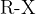 predstavlja organsko molekulo, na katero je vezan eden izmed halogenov
predstavlja organsko molekulo, na katero je vezan eden izmed halogenov 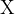 ) in bakrovim oksidom:
) in bakrovim oksidom:
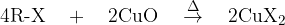
Nastane eden izmed bakrovih halidov (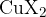 ). In šele nato se pojavi obarvan plamen:
). In šele nato se pojavi obarvan plamen:
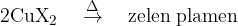
Ob prisotnosti kateregakoli izmed halogenih elementov, se plamen obarva zeleno (glej sliko 3).
Na sliki 3 je prikazana aparatura, s katero dokazujemo prisotnost halogenih elementov.
S pomočjo žarilne žičke nesemo vzorec nad plamen.
Na predelu žičke, ki ga izpostavimo plamenu, je prisoten naš vzorec.
Če vzorec vsebuje halogene elemente, plamen zagori zeleno (se obarva zeleno).
Dušik je vezan v organskih spojinah z močnimi kovalentnimi vezmi, zato je manj reaktiven. Dušik moramo najprej pretvoriti v reaktivnejšo obliko in šele nato ga dokazujemo. Pri tem imamo dve metodi:
alkalna hidroliza za dokaz dušika v aminokislinah,
razklop z natrijem in dokaz ionov.
Poglejmo obe dokazne reakciji podrobneje.
Pri alkalni hidrolizi spojino izpostavimo delovanju kalijevega hidroksida  . Reakcijsko zmes segrevamo (glej sliko 4).
. Reakcijsko zmes segrevamo (glej sliko 4).
Na sliki vidimo:
posodo, v kateri imamo organsko spojino v raztopini,
posodo, ki je izpostavljena segrevanju,
lakmusov papirček na posodi.
Poteče naslednja reakcija:
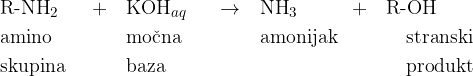
Iz spojine izpodrinemo amino skupino  in prične izhajati amonijak. Amonijeve raztopine so bazične:
in prične izhajati amonijak. Amonijeve raztopine so bazične:
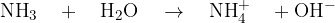
Prisotnost hidroksidnih ionov v pari dokažemo z mokrim lakmusovim papirčkom.
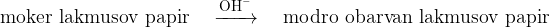
Pri bazičnih raztopinah se lakmusov papirček obarva modro.
Pri razklopu z natrijem pridobimo različne reaktivne ione. Pri različnih organskih spojinah nastanejo različni ioni. V primeru, ko imamo v spojini samo ogljik, vodik in dušik, se bo dušik pojavil v obliki cianidnega iona 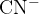 .
.
Prisotnost cianidnega iona dokažemo z nastankom železovega (III) heksacianoferata (II). To je kompleksna spojina, ki raztopino obarva intenzivno modre barve. Poglejmo reakcijo, kako tale kompleks nastane:
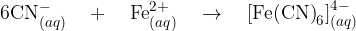
Novo nastali kompleksni ion reagira z železovim (III) ionom, pri čemer nastane oborina:
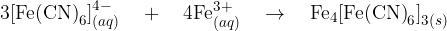
Modro oborino, ki nastane, opišemo kot berlinsko modra.
Za žveplo moramo, tako kot za dušik, najprej iz organske spojine pridobiti reaktivnejše ione. Organsko spojino spremenimo z razklopom z natrijem.
Če imamo v spojini, poleg ogljika in vodika, prisotno samo žveplo, bomo pri razklopu dobili sulfidni ion 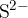 . Njegovo prisotnost lahko dokažemo s pomočjo svinčevega acetata
. Njegovo prisotnost lahko dokažemo s pomočjo svinčevega acetata 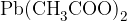 . Poglejmo reakcijo:
. Poglejmo reakcijo:
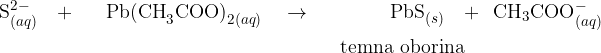
Svinčev (II) sulfid je temno rjava do črna oborina.
Rodanidni ion oziroma tiocianidni ion (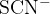 ) nastane pri razklopu organski spojin, ki poleg ogljika in vodika, vsebujejo:
) nastane pri razklopu organski spojin, ki poleg ogljika in vodika, vsebujejo:
tako dušik
kot žveplo.
Če tiocianidnim ionom dodamo železov (III) klorid, nastane kompleksen ion, ki raztopino obarva. Poglejmo reakcijo:
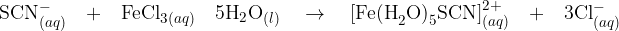
Nastali kompleksni ion obarva raztopino rubinasto redeče oziroma barvo opišemo kot krvavo rdeče.