Osebne zbirke


Karboksilne kisline so šibke kisline, vendar pa reagirajo z vrsto različnih snovi, kar privede do novih organskih spojin. Nekatere izmed kemijskih reakcij karboksilnih kislin smo že spoznali v prejšnjih gradivih (estrenje, protolitske reakcije), preostale bomo spoznali v tem tekstu.
Reakcije karboksilnih kislin so:
nastanek anhidridov
pretvorba v kislinske kloride
pretvorba v amide
Poglejmo si jih natančneje.
Protoliza je reakcija kislin z vodo. Kisline oddajo protone 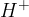 vodi, pri čemer nastaneta
vodi, pri čemer nastaneta
oksonijev ion in
kislinski anion.
Karboksilne kisline lahko oddajo samo vodikov atom iz karboksilne skupine 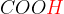 .
.
Organske kisline so šibke kisline: v raztopini take kisline le del molekul odda svoj proton, preostale pa ostanejo v izvornem stanju.
Tako kot protoliza je tudi nevtralizacija tipična reakcija vseh kislin. To je reakcija med kislinami in bazami. Pri tej reakciji vedno nastaneta sol in voda. Oglejmo si reakcijo med ocetno kislino in natrijevim hidroksidom:
Estrenje in poimenovanje estrov je natančneje obravnavano v samostojnih gradivih. Tukaj bomo samo osvežili predhodno znanje na praktičnem primeru.
Estrenje je reakcija med kislinami in alkoholi, pri čemer dobimo lahko hlapne in aromatične estre.
Podobno, kot lahko reagirata med seboj dve molekuli vode, tako lahko reagirata med seboj tudi dve molekuli kisline. Molekuli se med segrevanjem združita v večjo molekulo, pri tem pa se iz sistema odcepi voda:
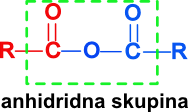
Slika 4: Splošna formula za anhidrid, v zelenem okviru imamo označeno značilno anhidridno skupino.
Organska molekula, ki nastane, se imenuje anhidrid. Pri tej kemijski reakciji lahko tvorimo samo simetrične anhidride, to je spojino, ki nastane iz identičnih molekul.
Pri segrevanju lahko med seboj reagirata tudi dve karboksilni skupini prisotni na isti molekuli. Tak tip reakcije imenujemo intramolekularna eliminacija vode. Pri tem se tvorijo ciklični anhidridi.
Kislinski kloridi so spojine, ki povezujejo tako karbonilno skupino (-C=O) kot halogeni element:
So idealni prekurzorji (izhodne spojine) za sintezo novih organskih spojin. Z njimi smo se že srečali pri aciliranju. Kisline lahko pretvorimo v kislinske kloride s pomočjo anorganskih reagentov:
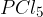
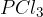
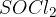
Glavni produkt naše reakcije bo vedno enak. Reakcije se med seboj razlikujejo le po stranskih produktih, ki pa jih običajno opustimo (jih ne zapišemo). Vseeno pa omenimo nekaj stranskih produktov:
Pri uporabi fosforjevega pentaklorida 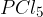 dobimo stranska produkta
dobimo stranska produkta 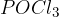 in
in 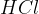 .
.
Pri uporabi fosforjevega triklorida 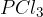 dobimo stranski produkt
dobimo stranski produkt 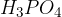 .
.
Pri uporabi tionil klorida 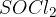 pa nastaneta dva stranska produkta:
pa nastaneta dva stranska produkta: 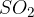 in
in 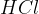 .
.
Poglejmo si primer.
Amidi so derivati organskih kislin, ki vsebujejo tako imenovano amidno skupino:
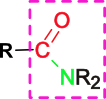
Slika 11: Shematski prikaz amida (R-predstavljajo alkilne verige).
Amide pridobivamo na dva načina:
z reakcijo med kislino in amonijakom,
z reakcijo med kislinskim kloridom in amonijakom.
Najprej si na praktičnem primeru oglejmo reakcijo med kislino in amonijakom. Reakcija je izredno podobna estrenju, saj se pri povezovanju obeh molekul prav tako odcepi voda.
Reakcija med kislinskim kloridom in amonijakom je podobna. Razlika je le v stranskem produktu, saj se v tem primeru odcepi 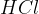 .
.
Na tej točki lahko omenimo tudi reakcije kislinski kloridov z alkoholi. Ta tip reakcije je podoben estrenju. Med to reakcijo in estrenjem je edina razlika v stranskem produktu: pri tej reakciji dobimo vodikov klorid ne pa vode.
Spoznali smo, kako lahko pretvorimo kislino v amid. Iz amidov pa lahko tvorimo amine s pomočjo segrevanja. S segrevanjem amidov povzročimo odcep vode iz molekule in nastanek nitrila, ki ga nato pretvorimo v amin s pomočjo redukcije.
Hidroliza je izraz za reakcije z vodo, kjer kislinski derivati razpadejo na:
osnovne kisline in
druge manjše spojine.
Hidroliza je obratni proces od reakcij, ki smo jih spoznali v gornjih poglavjih. Pogoj za potek hidrolize je kislo oziroma bazično okolje. Odvisno od izhodne spojine - to je spojine, ki jo želimo hidrolizirati - imamo temu primerno različne končne produkte. Ta tip reakcije poteka na:
estrih
anhidridih
amidih
kislinskih kloridih
Poglejmo si posamezne reakcije in njihove produkte.
Pri hidrolizi estrov v kislem okolju (to je takrat, ko so estri pomešani z 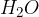 in
in 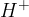 ) pretvorimo estre v:
) pretvorimo estre v:
kislino in
alkohol.
Pri hidrolizi estrov v bazičnem okolju (to je takrat, ko so estri pomešani s 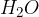 in
in 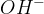 ) pretvorimo estre v:
) pretvorimo estre v:
karboksilni ion in
alkohol.
V bazičnih pogojih je kislina v obliki iona in skupaj z bazo tvori sol.
Pri bazični hidrolizi maščob (trigliceridov; estrov med maščobnimi kislinami in glicerolom) nastane milo in zato reakcijo poimenujemo umiljenje. Pri umiljenju nastanejo soli maščobnih kislin in glicerol.
Kisla hidroliza anihidridov privede do dveh molekul kisline.
Bazična hidroliza anihidridov privede do dveh molekul iona (v obliki soli).
Kisla hidroliza amidov privede do:
kisline in
amonijevega iona.
Pri hidrolizi dobimo izhodne molekule, iz katerih je amid nastal (kisline in amonijaka). Vendar pa se amonijak, zaradi kislih pogojev, pretvori v amonijev ion (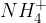 ).
).
Bazična hidroliza amidov privede do:
kislinskega iona in
amonijaka.
Kislinski kloridi se pri kisli hidrolizi pretvorijo v:
izhodno kislino in
vodikov klorid.
Ker nas zanimajo samo organske spojine in z namenom poenostavitve zapisa hidrolize, nastanka vodikovega klorida običajno ne zapišemo.
Kislinski kloridi se pri bazični hidrolizi pretvorijo v:
ion izhodne kisline in
kloridni ion.