Osebne zbirke


Soli so kemijske spojine, ki jih pogosto srečujemo v življenju. Tvorijo kristale, ki so pogosto topni v vodi.
Soli uvrščamo med ionske spojine. Sol je sestavljena iz:
kationov (pozitivni kovinski ion iz baze ali amonijev ion) in
anionov (negativni ion nekovine ali kislinski ostanek).
Pri poimenovanju soli posebej poimenujemo kationski in anionski del soli. Držimo se naslednjih korakov:
Zapišemo ime kovinskega kationa s slovensko osnovo. V primeru, da kation izvira iz baze amonijak, ga poimenujemo z besedo amonij.
Dodamo končnico -ev ali -ov,
Naredimo presledek in dodamo ime aniona:
v primeru aniona iz binarne kisline poimenujemo anion z latinskim imenom in dodamo končnico -id;
v primeru aniona iz oksokisline navedemo ime aniona, tako da vzamemo latinsko ime za centralni ion ter dodamo končnico -at.
V spodnji tabeli so razvrščene binarne kisline in oksokisline ter anioni, ki nastanejo iz njih. S pomočjo te tabele lahko razberemo imena posameznih anionov.
Pri zapisu formule najprej zapišemo kation, nato pa še anion:
Naboj kationa razberemo iz periodnega sistema elementov,
naboj aniona pa določimo glede na naboj kislinskega preostanka, iz katerega izhaja anion.
Ko zapisujemo formule soli, moramo vedno preveriti naboje ionov, iz katerih je sol sestavljena.
Ker so soli nevtralne spojine, moramo upoštevati naboje ionov, tako da se skupni pozitivni naboj kationov in negativni naboj anionov izničita.
Anione iz oksokislin obravnavamo v bloku. To pomeni, da jih upoštevamo kot da so ena enota, čeprav je anion sestavljen iz dveh nekovin.
Število posameznih ionov po potrebi spreminjamo tako, da damo celoten anion v oklepaj in število anionov zapišemo za oklepajem.
Podobno velja, če imamo v soli prisoten amonijev kation. Če moramo spremeniti število amonijevih ionov, potem damo celoten amonijev ion v oklepaj in število ionov zapišemo za oklepajem.
Pri zapisu soli, kjer anion izhaja iz karboksilne kisline, lahko v formuli najprej navedemo anion in šele nato kation. S takim zapisom poudarimo, da je kation povezan s kisikom, ki ima negativen naboj.
Tudi anioni iz karboksilnih kislin so sestavljeni iz več atomov, zato tudi pri spreminjanju števila anion karboksilne kisline zapišemo v oklepaj in za njim navedemo število anionov.
Soli nastanejo pri več reakcijah. V nadaljevanju si bomo posebej pogledali štiri kemijske reakcije, pri katerih kot produkt nastane sol.
Nevtralizacija je kemijska reakcije, pri kateri reagirata baza in kislina. Produkta reakcije nevtralizacije sta sol in voda.
Pri reakciji kisline in baze nastaneta sol in voda:
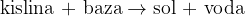
Reakcija nevtralizacije je podrobno opisana v gradivu nevtralizacija.
Soli nastanejo pri reakciji med kovino I. in II. skupine periodnega sistema in nekovino VII. skupine periodnega sistema. Pri reakciji nastane le en produkt in to je sol.
Pri reakciji kovine in nekovine nastane sol:
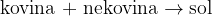
Reakcija poteče med kovino in kislino. Produkta pri reakciji sta sol in plin vodik 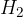 .
.
Pri reakciji med kovino in kislino nastaneta sol in vodik:
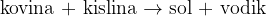
Reakcija poteče med kovinskim oksidom in kislino. Kovinski oksid je spojina, sestavljena iz nekovine in kisika. Produkta reakcije sta sol in voda.
Pri reakciji med kovinskim oksidom in kislino nastaneta sol in voda:
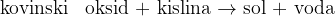
Zaradi enostavnosti pridobivanja imajo soli pomembno mesto v vsakdanjem življenju. Uporabljamo jih v prehrani, medicini in industriji. Pogledali si bomo uporabo nekaterih soli.
Natrijev klorid
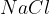 je sol slanega okusa in jo imenujemo tudi kuhinjska sol. Kuhinjska sol je bistvena sestavina v kulinariki, kjer se uporablja za izboljšanje okusa in konzerviranje hrane. Pozimi pa kuhinjsko sol uporabljajo tudi za posipanje cest.
je sol slanega okusa in jo imenujemo tudi kuhinjska sol. Kuhinjska sol je bistvena sestavina v kulinariki, kjer se uporablja za izboljšanje okusa in konzerviranje hrane. Pozimi pa kuhinjsko sol uporabljajo tudi za posipanje cest.
Kalcijev klorid
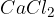 znižuje tališče ledu in snega, zato se uporablja za posipanje cest pozimi. Prav tako se uporablja kot sušilno sredstvo za odstranjevanje vlage iz zraka.
znižuje tališče ledu in snega, zato se uporablja za posipanje cest pozimi. Prav tako se uporablja kot sušilno sredstvo za odstranjevanje vlage iz zraka.
Kalcijev karbonat
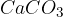 je sol nevtralnega okusa. Je pomemben sestavni del gradbenih materialov, kot so beton, cement in omet. Uporablja se v prehranskih dopolnilih, saj je kalcij osnovni gradnik kosti.
je sol nevtralnega okusa. Je pomemben sestavni del gradbenih materialov, kot so beton, cement in omet. Uporablja se v prehranskih dopolnilih, saj je kalcij osnovni gradnik kosti.
Magnezijev sulfat
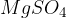 je poznan kot grenka sol in se uporablja v medicini kot odvajalo in sredstvo za lajšanje mišičnih bolečin, zmanjšanje vnetij in zdravljenje pomanjkanja magnezija. V kmetijstvu se uporablja kot gnojilo za rastline, ki potrebujejo dodatne količine magnezija.
je poznan kot grenka sol in se uporablja v medicini kot odvajalo in sredstvo za lajšanje mišičnih bolečin, zmanjšanje vnetij in zdravljenje pomanjkanja magnezija. V kmetijstvu se uporablja kot gnojilo za rastline, ki potrebujejo dodatne količine magnezija.
Natrijev hidrogenkarbonat
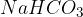 , ki ga poznamo tudi pod imenom soda bikarbona, je sol, ki ima rahlo slan okus. Uporablja se v prehrani kot vzhajalno sredstvo pri peki, saj sprošča ogljikov dioksid in s tem omogoča vzhajanje testa. V medicini se uporablja kot antacid za lajšanje zgage in prebavnih težav.
, ki ga poznamo tudi pod imenom soda bikarbona, je sol, ki ima rahlo slan okus. Uporablja se v prehrani kot vzhajalno sredstvo pri peki, saj sprošča ogljikov dioksid in s tem omogoča vzhajanje testa. V medicini se uporablja kot antacid za lajšanje zgage in prebavnih težav.