Osebne zbirke


Pojma oksidacija in redukcija obravnavamo v anorganski kemiji pri redoks reakcijah. V organski kemiji ju uporabljamo, ko:
pretvarjamo alkohole do aldehidov in ketonov ter vse tja do kislin;
pretvarjamo kisline, aldehide in ketone v alkohole;
spreminjamo nasičenost spojin.
Z drugimi besedami: ta dva pojma pojmujemo kot postopka za pripravo različnih vrst spojin. Procesa sta si nasprotna:

Poglejmo si ju podrobneje.
Pojem oksidacija uporabimo v dveh primerih:
pri gorenju organskih spojin (popolna oksidacija);
V obeh primerih je potrebna prisotnost kisika.
Popolna oksidacija (gorenje) je reakcija značilna predvsem za ogljikovodike. Pri gorenju se ogljikovodik pretvori (razgradi) vse do ogljikovega dioksida in vode:
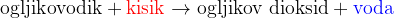
Povsem enako velja za popolno oksidacijo organskih kisikovih spojin.
Za razliko od drugih organskih reakcij, kjer se običajno posvetimo samo substratu in produktu, pa reakcije popolne oksidacije vedno stehiometrično uredimo.
Oksidacija alkoholov in aldehidov je proces uvajanja kisikovih atomov v strukturo molekule. Vse reakcije potekajo v kislem okolju.
Pri oksidativnih pretvorbah alkoholov in aldehidov označimo postopek oksidacije s pomočjo:
znaka 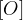 oziroma
oziroma
močnih anorganskih oksidantov kot sta 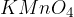 in
in 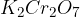 (če jih pri reakciji uporabimo)
(če jih pri reakciji uporabimo)
lahko enostavno zapišemo besedo "oksidacija".
Poleg tega pa običajno pod pojmom oksidacija opisujemo pretvorbe:
Opišimo sliko 2:
V prvi stopnji oksidacije hidroksilna skupina (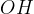 ) preide do karbonilne skupine (
) preide do karbonilne skupine (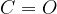 ).
).
V drugi stopnji oksidacije pa se karbonilna skupina pretvori v karboksilno skupino (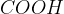 ).
).
Stopnja pretvorbe je odvisna od tipa začetne spojine. Poznamo namreč različne tipe alkoholov (tako kot ogljikovih atomov) in sicer:
primarni alkoholi (slika 3A),
sekundarni alkoholi (slika 3B),
terciarni alkoholi (slika 3C).
Poglejmo si vse tri tipe alkoholov podrobneje:
Primarni alkoholi
Pri primarnih alkoholih je hidroksilna skupina vezana na skrajnem ogljikovem atom (na koncu verige). Tak ogljik ima samo eno izmed vezi zasedeno z ogljikom.
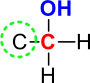
Slika 4: Pri primarnih alkoholih je ogljik, na katerega je vezana hidroksilna skupina, povezan z le enim ogljikom.
Sekundarni alkoholi
Pri sekundarnih alkoholih je hidroksilna skupina vezana na enega izmed centralnih atomov (znotraj verige). Le-ta ima dve vezi zasedene z ogljiki, tretja prosta vez je povezana z vodikom.
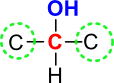
Slika 5: Pri sekundarnih alkoholih je ogljik, na katerega je vezana hidroksilna skupina, povezan z dvema drugima ogljikoma.
Terciarni alkoholi
Pri terciarnih alkoholih je hidroksilna skupina vezana na ogljik, ki ima preostale tri vezi zasedene z ogljiki.
Lahko se primeri, da je v isti molekuli vezanih več hidroksilnih skupin. V takem primeru določimo za vsako posamezno hidroksilno skupino, na katerem ogljikovem atomu leži.
Primarni alkoholi najlažje oksidirajo v višjo oksidativno obliko. V prvi stopnji se pretvorijo v aldehide:
V drugi stopnji pa oksidirajo do karboksilnih kislin:
Oksidacija primarnih alkoholov poteka do kislin.
Glede na stopnje oksidacije primarnih alkoholov lahko sklepamo, da lahko aldehide oksidiramo do kislin.
Oksidacija sekundarnih alkoholov privede do ketonov, kjer se proces oksidacije tudi ustavi.
Oksidacija sekundarnih alkoholov poteka do ketonov.
Oksidacija ketonov v kisline lahko poteče samo pod ostrimi pogoji (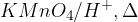 ). Pri tem pa se osnovna struktura razcepi in pride do tvorbe dveh različnih kislin.
). Pri tem pa se osnovna struktura razcepi in pride do tvorbe dveh različnih kislin.
Oksidacija terciarnih alkoholov (s pomočjo oksidantov) ne poteče. Na strukturi ne pride do sprememb.
V primeru, da terciarne alkohole oksidiramo v ekstremnih pogojih, bodo le-ti razpadli.
Ko smo neodločeni o izidu naših reakcij, si lahko pomagamo z naslednjo razpredelnico:
Redukcija je proces, v katerem obstoječim molekulam v strukturo dodajamo vodikove atome. Proces lahko opravimo:
s pomočjo močnega reducenta kot je 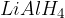 ;
;
s katalitičnim hidrogeniranjem molekul (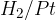 ).
).
Kot redukcijo lahko pojmujemo:
spreminjane karboksilnih kislin, aldehidov in ketonov do alkoholov.
Pri uvajanju vodikovih atomov v strukture alkenov in alkinov, se spreminja nasičenost le-teh:
alkeni pa se nato pretvorijo v alkane.
Pri tem procesu lahko uporabimo katerega koli izmed prej omenjenih reducentov: 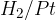 ali
ali 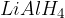 .
.
Redukcija organskih kisikovih spojin je obraten proces od oksidacije. Kar pomeni, da lahko ob prisotnosti ustreznega reagenta:
kisline pretvorimo v aldehide,
aldehide pretvorimo v primarne alkohole,
ketone pretvorimo v sekundarne alkohole.
Slika 36 shematsko prikazuje pretvorbo funkcionalnih skupin pri redukciji:
Karboksilna skupina kislin se pretvori v karbonilno.
Karbonilne skupine ketonov in aldehidov pa se pretvorijo v hidroksilne skupine.
Tudi v tem primeru uporabimo enega izmed predhodno naštetih reducentov.