Osebne zbirke


Raztopine so homogene zmesi sestavljene iz dveh ali več sestavin. Raztopine so disperzni sistem, v katerem je:
topljenec (dispergirana faza) primešan
topilu (disperznemu mediju).
Topilo imenujemo snov, ki v raztopini prevladuje. Topljenec pa imenujemo snov, ki je primešana topilu in je v manjšino raztopine.
Največkrat pod pojmom raztopina pojmujemo tekoče raztopine, ki so zmesi tekočega topila in raztopljenega topljenca.
Posamezne raztopine med seboj ločujemo glede na velikost delcev topljenca. Delimo jih na:
prave raztopine,
koloidne raztopine,
suspenzije.
Predno pa posamezne raztopine natančneje spoznamo, najprej uvedimo pojem fazna meja. Fazna meja je meja, ki nastane med dvema snovema, ki se med seboj ne mešata. Vidimo jo s prostim očesom. Pri pravih raztopinah - to je raztopinah, ki se med seboj mešajo - te meje ne zaznamo, saj se molekule topljeneca porazdelijo med molekule topila.
Prave raztopine imajo delce manjše od 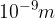 . V pravi raztopini so v topilu raztopljeni:
. V pravi raztopini so v topilu raztopljeni:
ioni in
manjše molekule.
Koloidna raztopina je heterogena zmes snovi, v katerih je ena snov fino razpršena v drugi snovi. Koloidne raztopine imajo večje delce topljenca. Velikost se vrti v območju od 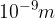 do
do 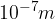 . V ta velikostni razred spadajo:
. V ta velikostni razred spadajo:
orjaške molekule (proteini, maščobne molekule...),
skupki atomov (delci zlata, koloidno srebro...),
manjši amorfni delci (minerali nepravilnih oblik).
Koloidne raztopine so lahko navidezno prozorne in jih lahko na prvi pogled zamešamo s pravimi raztopinam. Da gre za koloidno raztopino in ne pravo raztopino, lahko ugotovimo s Tyndallovim eksperimentom.
Tyndallov eksperiment je preprost poskus, s katerim ločujemo koloidne raztopine od pravih. Postopek poteka tako: skozi raztopino posvetimo s snopom svetlobe. V primeru:
koloidnih raztopin, lahko snop svetlobe lepo vidimo čez celotno dolžino raztopine;
pravih raztopin žarka v raztopini ne vidimo.
Kaj se zgodi? Delci v pravih raztopinah so majhni, zato se svetloba od delcev ne odbija. Posledično, svetlobe ne vidimo, saj vsa potuje skozi tekočine brez ovir. V primeru koloidnih raztopin pa so delci večji. Svetloba se od njih delno odbija v vse smeri - tudi v smer našega očesa.
Poglejmo Tyndallov efekt v praksi.
Suspenzija je zmes nekega topila in v njem netopne snovi. V primeru suspenzij je fazna meja med topljencem in topilom dobro vidna: delce topljenca vidimo, saj se le-ta ne raztaplja. Tak sistem je običajno neobstojen, saj se delci pričnejo posedati na dno posode in se topilo in topljenec ponovno ločita.
Topljenec je vsaka snov, ki se lahko raztopi v tekočini. To so lahko:
ionski kristali (razne soli kot je natrijev klorid)
molekulski kristali (kot je sladkor)
...
Topilo je medij, v katerem raztapljamo topljenec. Ločimo dve vrsti topil:
Polarna topila
Polarna topila so sestavljena iz polarnih molekul. Topljenci se raztapljajo po principu "podobno v podobne". V polarnih topilih se raztapljajo ionski kristali in polarne molekule.
Nepolarna topila
Nepolarna topila so sestavljena iz nepolarnih molekul in v njih se raztapljajo nepolarne molekule.
Raztapljanju topljenca v topilu pravimo solvatacija. To je proces, v katerem molekule topila ustvarijo medmolekulske vezi (van der Waalsove vezi) z molekulami topljenca in zrušijo kristalno strukturo le-tega. Molekule topljenca se obdajo z molekulami topila in se porazdelijo po celotnem volumnu. Proces prikazuje naslednja slika:
V primeru, ko je topilo voda, proces imenujemo hidratacija. V tem primeru voda napade molekule topljenca in razruši kristalno strukturo.
Topnost je lastnost snovi, da se njeni gradniki porazdelijo med gradniki druge snovi. Matematično je definirana kot maksimalna masa topljenca, ki ga lahko raztopimo na 100 gramov topila.
Topnosti je razmerje, ki pove maksimalno mase topljenca, ki jo lahko raztopimo v 100 gramih topila:
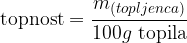
Topnost je odvisna od:
topila (polarno, nepolarno),
topljenca (sol, organska molekula, kovina),
temperature.
Temperatura je dejavnik, ki vpliva na hidratacijsko in mrežno entalpijo. Velja, da:
če je raztapljanje endotermen proces, se bo topnost zvišala z višjo temperaturo;
če je raztapljanje eksotermen proces, se bo topnost znižala z višjo temperaturo.
Topnost snovi je omejena. Pri določeni temperaturi lahko raztopimo največ samo določeno količino topljenca. Ko navajamo topnost pri določeni temperaturi, se topnost nanaša na nasičeno raztopino.
Nasičena raztopina je raztopina, v kateri smo raztopili maksimalno možno količino topljenca. Če bomo v raztopino še dodajali topljenec, se le ta ne bo več raztapljal temveč se bo usedel na dno raztopine. Stopnja nasičenosti (koliko topljenca lahko maksimalno raztopimo v dani raztopini) je odvisna od temperature.
Kristalizacija spojin je postopek, kjer se iz homogenih raztopin pričnejo izločati kristali topljenca. To se zgodi zaradi odvisnost topnosti od temperature. Proces je prikazan na naslednji sliki:
Poglejmo si proces kristalizacije na praktičnem primeru.
Sestavo raztopin največkrat podajamo s koncentracijo. Koncentracija je fizikalna količina, ki izraža količino topljenca na volumen raztopine. Poznamo:
množinsko koncentracijo,
masno koncentracijo.
Poglejmo si jih podrobneje.
Množinska koncentracija je količina, ki nam poda množino topljenca na volumensko enoto raztopine. Označujemo jo s  in ima enote
in ima enote 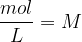 .
.
Množinsko koncentracijo računamo kot kvocient med množino topljenca in volumnom raztopine:
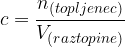
Enota koncentracije je 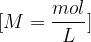 .
.
Masna koncentracija je količina, ki nam poda maso topljenca na volumen celotne raztopine. Označimo jo s 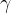 in ima enote
in ima enote 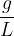 .
.
Masna koncentracija je kvocient med maso topljenca in volumnom raztopine:
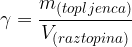
Pri računanju masne koncentracije moramo biti pazljivi, da je ne zamešamo z gostoto raztopine. Razlika je, da:
pri računanju masne koncentracije uporabljamo samo maso topljenca,
pri računanju gostote raztopin pa uporabimo celotno maso raztopine.
Masa raztopine je vsota mase topljenca in mase topila:
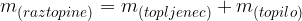
Poglejmo si na praktičnem primeru razliko med masno koncentracijo in gostoto raztopine.
Poleg koncentracije topljenca v raztopini se velikokrat srečamo tudi z masnim deležem topljenca v raztopini. masni delež predstavlja maso topljenca na maso raztopine. Označujemo ga z 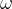 in nima enot:
in nima enot:
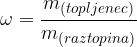
Tudi v tem primeru moramo biti pazljivi, da ne zamešamo pojma masni delež in topnost.
Priprava osnovnih raztopin poteka tako, da običajno trden topljenec raztopimo v topilu.
Če želimo dobiti raztopino z določeno koncentracijo, moramo odtehtati želeno količino topljenca in ga dodamo v izbrano količino topila.
Raztapljanja trdnega topljenca v topilu pa ni edini način za pripravo raztopine z želenimi lastnostmi. Raztopine lahko pripravimo tudi z:
mešanjem dveh raztopin,
redčenjem,
koncentriranjem
Poglejmo si slednji dve natančneje.
Redčenje raztopin je postopek, kjer že obstoječi raztopini dodamo topilo, pri tem se koncentracija topljenca zmanjša. Koncentracija se zmanjša, ker za enako število molov topljenca, imamo večjo količino topila.
Koncentriranje raztopin je obraten proces od redčenja. Koncentriranje raztopin je postopek, pri katerem odvzemamo topilo raztopini. Pri tem množina topljenca ostane nespremenjena, vendar pa je raztopljena v manjši količini topila. Najpogosteje topilo odparimo, saj običajno imajo nizka vrelišča in jih z lahkoto prevedemo v plinasto stanje (s segrevanjem).