Osebne zbirke


Snov je katerakoli stvar, ki nas obdaja ali je del nas in ima specifično kompozicijo in lastnosti.
Najosnovnejša delitev kemičnih snovi je na:
čiste snovi,
zmesi.
Čista snov je sestavljena iz ene same vrste delcev. Delci so lahko:
elementi. Elementi so katerikoli atomi kovin (npr. Au, Pt) ali molekule nekovin (npr. 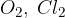 ).
).
spojine. Spojine so katerekoli molekule, ki so sestavljene iz dveh ali več atomov (npr. 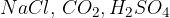 ).
).
Vsaka čista snov ima točno določeno sestavo in lastnosti.
Zmes je mešanica dveh ali več čistih snovi, ki jih premešamo med seboj. Ločimo jih v homogene zmesi (raztopine) in heterogene zmesi (koloidi, suspenzije). Sestave zmesi lahko spreminjamo in s tem tudi njihove lastnosti.
Zmesi nastanejo, če zmešamo dve ali več snovi skupaj. Ker je to fizikalni postopek - kar pomenim da se pri mešanju ne prekinjajo stare vezi in ne nastajajo nove - se pri mešanju ne sprošča nikakršna energija. Kot rečeno, so lastnosti zmesi v splošnem so nedefinirane in so odvisne od danega razmerja zamešanih snovi.
Zmesi delimo na:
Homogene zmesi
Homogene zmesi so zmesi, kjer so snovi med seboj enakomerno porazdeljene. Pri tem ne opazimo fazne meje (prehoda) med eno snovjo in drugo.
Heterogene zmesi
Heterogene zmesi so zmesi, kjer se snovi med seboj ne porazdelijo enakomerno. Pri tem je mogoče opaziti tudi prehod iz ene snovi v drugo. Ločimo jih na:
zlitine,
Na spodnji shemi je prikazana razdelitev snovi.
Snovi lahko definiramo tudi po njihovih agregatnih stanjih. Poznamo naslednja osnovna agregatna stanja:
trdno, ki ga označujemo s simbolom s (iz angleškega izraza solid);
tekoče (kapljevinasto) agregatno stanje, ki ga označujemo s simbolom l (iz angleškega izraza liquid);
plinasto agregatno stranje, ki ga označujemo s simbolom g (iz angleškega izraza gas).
V kemiji se večkrat srečamo tudi s posebnim stanjem sistema:
raztopljenim stanjem, ki ga označimo s simbolom aq (iz angleškega izraza aqeuous). To je stanje sistema, kjer so ioni molekul obdani s topilom. Uporablja se za opis razopin, kjer so posamezne molekule disociirane in raztopljene v vodnem mediju.
V trdnem agregatnem stanju so delci povezani tesno skupaj. Med njimi vladajo močne privlačne sile. Struktura snovi je lahko:
kristalna, kar pomeni, da so gradniki snovi povezani z določeno in urejeno strukturo;
amorfna, kar pomeni, da so gradniki povezani tesno skupaj a na neurejen način.
Gradniki, ki lahko sestavljajo trdno snov, so:
ioni povezani med seboj z ionskimi vezmi,
molekule povezane med seboj s molekulskimi (van der Waalsovimi) vezmi),
kovine povezane v kristalno strukturo s kovinskimi vezmi,
nekovine povezane med seboj s kovalentnimi vezmi.
Vsaka izmed zgoraj naštetih snovi ima različne lastnosti, ki pa so podrobneje obravnavani v gradivu Lastnosti trdnih snovi. Trdne snovi imajo lastno obliko, ki se ne spreminja (razen pod vplivom zunanjih sil) in s tem zasedajo omejen volumen.
V tekočem agregatnem stanju so delci sicer povezani z vezmi, vendar pa so le te šibke. Gradniki so prosto plavajoči in se lahko prosto premikajo. Tekočine nimajo lastne oblike in pridobijo obliko posode, ki jim je na voljo.
Volumen tekočine je odvisen od:
temperature sistema: nižja je temperatura, krajše so razdalje med delci, bolj gosta in kompaktnejša postane.
tlaka, ki pa je zaradi bližine delcev skorajda zanemarljiv.
V tekočem agregatnem stanju sta vpliva tako temperature kot tlaka precej manjša kot pa v primeru plinastih stanj.
V plinastem agregatnem stanju imajo molekule tako visoko kinetično energijo, tako da so medmolekulske vezi med posameznimi molekulami pogosto zanemarljive. Zato se delci plina prosto gibljejo po vsem volumnu (prostoru - ki ga tudi v celoti zasedejo). Volumen plinov je odvisen od:
temperature (s segrevanjem plina se le-ta razširi)
tlaka (z večanjem tlaka plin stiskamo).
S pomočjo ohlajanja in stiskanja, plinom lahko zmanjšamo volumen vse do trenutka, ko se utekočinijo.
Običajno, ko govorimo o agregatnih stanjih, v večini primerov opisujemo čiste snovi. "Aqueous" ali raztopljeno stanje je v bistvu stanje raztopin, kjer so molekule spojin obdane z vodnimi molekulami. Torej s tem pojmom opisujemo raztopine in njihovo stanje. Običajno so hidratizirane molekule kot so ioni in kisline ali baze, v disociiranem oziroma protoliziranem stanju.
Ker med pripravljanjem zmesi ne pride do nikakršnih kemijskih sprememb, lahko le-te ponovno ločimo. V odvisnosti od vrste zmesi in njene lastnosti lahko izberemo različne postopke ločevanja. Pri ločevanju izkoristimo razlike med posameznimi komponentami. Pri določitvi metode za ločevanje zmesi se opremo predvsem na fizikalne lastnosti, kot so:
topnost v različnih medijih,
velikost delcev,
vrelišče,
sublimacija,
agregatno stanje,
in druge lastnosti.
Pri ločevanju glede na velikost delcev lahko uporabljamo naslednje postopke:
sedimentacija in dekantiranje. To je postopek, ko nastane usedlina in lahko tekočino enostavno odtočimo iz posode, pri tem pa pazimo, da se vsebina ponovno ne premeša.
kristalizacija in filtriranje. To je postopek, kjer uporabimo filtre različnih velikosti: pri tem se večji delci zadržijo na filtru, preostala vsebina pa se pretoči v drugo posodo.
centrifugiranje. To je postopek, kjer s pomočjo centrifugalne sile ločimo delce med seboj na podlagi molske mase.
Pri ločevanju glede na vrelišče uporabimo metodo evaporacije. To je postopek, ko s segrevanjem odparimo topilo, preostane pa topljenec.
Pri ločevanju trdnih zmesi uporabljamo:
sublimacijo. To je postopek, ko ena izmed komponent pri segrevanju takoj preide v plinasto agregatno stanje ne da bi se utekočinila.
magnetno separacijo. To je postopek, ko je eno izmed komponent privlači magnetno polje.
ekstrakcijo. To je postopek, ko je ena izmed komponent topna (druge pa ne) in jo lahko raztopimo v vodi.
kromatografijo. To je metoda, ki izkorišča različno zadrževaje delcev v poroznem materialu, ki se nato ločijo po velikosti.
Pri ločevanju tekočin izkoriščamo različne temperature vrelišča. Postopek imenujemo:
frakcionirna destilacija.
Pri ločevanju tekočin izrabimo tudi različne gostote tekočin. Postopku pravimo:
ločevanje z lijem ločnikom.