Osebne zbirke


Molekule so gradniki snovi, ki so sestavljeni iz atomov, povezanih s kovalentnimi vezmi. Najmanjše molekule so sestavljene iz dveh atomov (in jim zato rečemo dvoatomne molekule), obstajajo pa tudi molekule, sestavljene iz po več milijard atomov.
Vsaka molekula ima značilno prostorsko razporeditev atomov - značilno obliko. Skozi to gradivo bomo podrobneje spoznali:
kako predstavimo zgradbo molekul,
prostorsko razvrščanje elektronskih parov in atomov,
kako ugotoviti (predvideti) obliko določene molekule in narisati strukturno formulo,
določanje polarnosti molekul.
Gradniki snovi - atomi, molekule in ioni - so tako majhni, da jih ni mogoče videti niti pod najmočnejšimi optičnimi mikroskopi. To pomeni, da z njimi nimamo čutne izkušnje iz vsakdanjega življenja. Zato si jih poskušamo predstavljati. Pri tem si pomagamo z različnimi zapisi - formulami in modeli.
S formulami in modeli prikažemo bistvene značilnosti molekul. Nobena formula niti model ni popolna, realna predstavitev - a z njihovo pomočjo lahko razberemo najpomembnejše značilnosti molekule, ki določajo fizikalne in kemijske lastnosti snovi. Zato je sposobnost zapisovanja in "branja" formul ena ključnih za dobro razumevanje kemije.
Poglejmo si najpogosteje uporabljene modele in formule na primeru berilijevega diklorida, ene najenostavnejših molekul.
Najpogosteje uporabljane formule
Tabela 1 prikazuje najpogosteje uporabljane formule.
Najpogosteje uporabljani modeli
Tabela 2 prikazuje najpogosteje uporabljane modele.
Oblike molekul so določili eksperimentalno (na osnovi različnih metod strukturne analize). V mnogih primerih je mogoče predvideti obliko molekule že na osnovi njene sestave oziroma molekulska formule. V tem poglavju se bomo naučili, kako ugotoviti obliko molekule - njeno strukturno formulo - na osnovi molekulske formule.
Pojem "enostavna molekula" nam v tem besedilu pomeni tole:
v molekuli sta največ dve vrsti atomov (gre za element, npr. 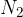 ali binarno spojino, npr.
ali binarno spojino, npr. 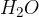 );
);
en atom je v središču molekule (centralni atom), vsi drugi atomi so vezani nanj;
v molekuli so samo enojne vezi ali nevezni elektronski pari, ni dvojnih ali trojnih vezi.
Za oblike enostavnih molekul velja:
Vse dvoatomne molekule so linearne oblike.
Razporeditev elektronskih parov okrog centralnega atoma je odvisna izključno od števila elektronskih parov.
Elektronski pari se razporedijo v prostoru tako, da so maksimalno oddaljeni drug od drugega.
Tabela 3 niza shematske prikaze možnih prostorskih razporeditev elektronskih parov okrog centralnega atoma.
Oblika molekule NE ustreza nujno skici razporeditev elektronskih parov (drugi stolpec v tabeli 3). Če so v molekuli samo vezni elektronski pari (in torej ni neveznih elektronskih parov), oblika molekule ustreza razporeditvi elektronskih parov (kar prikazuje četrti stoplec v tabeli 3). V nasprotnem primeru pa moramo obliko molekule določiti drugače.
Pri risanju strukturne formule najprej ugotovimo število elektronskih parov okrog centralnega atoma;
Kadar so vsi elektronski pari vezni (ni neveznih parov), je oblika molekule enaka razporeditvi elektronskih parov (desni, četrti, stoplec v tabeli 3). Kovalentne vezi (črtice) narišemo v takšni prostorski razporeditvi, kot prikazujejo gornje skice.
Kadar so v molekuli tudi nevezni elektronski pari, narišemo toliko vezi (črtic), kot je vezanih atomov. Neveznih elektronskih parov ne narišemo kot črte, ampak kot dve piki (glej drugi spodnji primer, kjer obravnavamo strukturo molekule vode).
Pri določanju oblik molekul z neveznimi elektronskimi pari si bomo pomagali s preglednico, v kateri so navedene tri najpogostejše oblike takih molekul:
Gornja tabela, tabela 4, prikazuje oblike molekul z neveznimi elektronskimi pari. Te oblike bi nastale tako, da bi iz molekule s samimi veznimi elektronskimi pari "odtrgali" enega ali dva atoma, razporeditev elektronskih parov pa bi ostala nespremenjena.
Postopek ugotavljanja oblike molekule na osnovi molekulske formule je:
ugotovimo, kateri je centralni atom - to je tisti, ki je v molekuli en sam;
ugotovimo število elektronskih parov okrog centralnega atoma;
iz lege centralnega atoma v periodnem sistemu ugotovimo število njegovih zunanjih elektronov (število elektronov je enako rimski številki skupine, v kateri je element);
prištejemo število vezanih atomov (v enostavnih molekulah vsak vezani atom prispeva natanko en elektron k zunanjim elektronom centralnega atoma);
seštevek - število elektronov - delimo z dva, da dobimo število elektronskih parov;
narišemo razporeditev elektronskih parov okrog centralnega atoma;
v središče mulekule napišemo simbol centralnega atoma;
okrog narišemo ustrezno število vezi in vezanih atomov v takšni geometrijski razporeditvi, ki ustreza številu elektronskih parov okrog centralnega atoma (glej slike v tabeli 3);
nevezne elektronske pare narišemo kot dve piki in ne kot črtice (glej drugi primer - strukturna formula molekule vode).
Poudarimo: pri tvorbi kovalentnih vezi ne velja vedno poenostavljeno pravilo, da naj bi imel vsak atom v spojini polno zunanjo lupino, torej 8 elektronov na zadnji lupini. Kot lahko razberemo iz gornjih skic, je mogoče, da sta okrog nekega atoma le dva elektronska para (to so štirje elektroni), nekateri atomi pa imajo lahko okrog sebe do šest elektronskih parov (12 elektronov).
Poglejmo si na dveh primerih, kako lahko ugotovimo obliko določene molekule in narišemo njeno strukturno formulo. Pri tem:
prvi primer obravnava molekule s samimi veznimi elektronskimi pari,
drugi primer pa molekulo z veznimi in neveznimi elektronskimi pari.
In še primer molekule z veznimi in neveznimi elektronskimi pari.
Elektronski pari se v prostoru razporedijo tako, da so maksimalno oddaljeni drug od drugega. Pri tem pa upoštevamo še Nyholm-Gilespiejevo pravilo o odboju elektronskih parov:
najmočneje se med seboj odbijajo nevezni elektronski pari;
nekoliko manjši je odboj med veznim in neveznim elektronskim parom;
najmanj se med seboj odbijajo vezni elektronski pari.
V praksi ta pravila pomenijo, da nevezni elektronski pari zavzamejo več prostora kot vezni. V molekulah z neveznimi elektronskimi pari so zato včasih valenčni koti (koti med vezmi) manjši, kot bi bili sicer.
Poglejmo si dva primera.
Omenili smo že, da oblike molekul (in s tem valenčne kote) določamo eksperimentalno. Valenčne kote lahko v mnogih primerih tudi izračunamo. V molekuli metana, kjer nastopajo samo med seboj enakovredni vezni elektronski pari, bi lahko enostavno izračunali kote znotraj tetraedra oziroma trikotne enakostranične piramide. V mnogih primerih je ugotavljanje / računanje valenčnega kota še enostavnejše.
Do zdaj smo spoznali zgradbo molekul, ki so sestavljene iz:
enega centralnega atoma,
na katerega so vezani enaki atomi s samimi enojnimi vezmi.
V nadaljevanju bomo to znanje nadgradili.
Dopustimo še dvojne in trojne vezi; obravnavali bomo zgradbo molekul, ki so sestavljene iz:
enega centralnega atoma
in na katerega so vezani različni atomi z enojnimi, dvojnimi ali trojnimi vezmi.
Predno pa nadaljujemo, spoznajmo kaj pomeni elektronski oblak.
Ko uporabimo izraz elektronski oblak, imamo v mislih:
vez: enojna, dvojna ali trojna vez predstavlja en sam elektronski oblak;
nevezni elektronski par.
Določanje oblike molekul: osnovne oblike molekul z dvojimi ali trojnimi vezmi so enake oblikam molekul z enojnimi vezmi. Pravzaprav se določanje strukture razlikuje le v eni "drobni", a bistveni razliki: namesto posamičnih elektronskih parov se razporedijo v prostoru elektronski oblaki, ki so sestavljeni iz enega, dveh ali treh elektronskih parov.
Razporeditev elektronskih oblakov okrog centralnega atoma je odvisna izključno od števila elektronskih oblakov.
Koristno je poznati, na kakšen način se vežejo nekateri atomi na centralni atom. Naslednji pregled velja znotraj trenutnega podpoglavja (pri molekulah z več centralnimi atomi so možne tudi druge kombinacije):
Atom vodika in atomi halogenov se vežejo na centralni atom z enojno vezjo.
Atom kisika praviloma tvori dve kovalentni vezi; na centralni atom se veže z dvojno vezjo.
Atom dušika praviloma tvori tri kovalentni vezi; na centralni atom se lahko veže s trojno vezjo.
Strukturne formule molekul v tem podpoglavju ugotavljamo na podoben način kot v primeru enostavnih molekul, le da moramo ugotoviti število elektronskih oblakov okrog centralnega atoma. Opis ugotavljanja strukture molekul bo nekoliko manj podroben, saj temelji na ugotavljanju oblike enostavnih molekul (z enojnimi vezmi), torej na predhodnih izkušnjah iz tega gradiva.
Pri določanju strukture molekul z dvojnimi in trojnimi vezmi lahko sledimo naslednjemu postopku:
Ugotovimo centralni atom in število njegovih zunanjih elektronov.
Ugotovimo število vezi, s katerimi so drugi atomi vezani na centralni atom.
Izračunamo število neveznih elektronskih parov na centralnem atomu:
(število neveznih elektronov) = (število zunanjih elektronov) - (število vezi);
(število neveznih elektronskih parov) = (število neveznih elektronov) / 2
Preštejemo elektronske oblake:
vsak atom je vezan na centralni atom z enim elektronskim oblakom (drugače povedano - vsaka enojna, dvojna ali trojna vez je en elektronski oblak);
vsak nevezni elektronski par je en elektronski oblak.
Narišemo strukturno formulo:
v središču je centralni atom,
okrog narišemo atome, vezane z ustreznim številom vezi,
narišemo nevezne elektronske pare,
geometrijska razporeditev vezi in neveznih elektronskih parov mora biti ustrezna glede na število elektronskih oblakov.
Doslej smo se v gradivu ukvarjali samo z molekulami, v katerih so vsi atomi vezani na enega osrednjega. Zdaj je pred nami še zadnji korak - spoznati molekule, kjer je več atomov - več središč, na katere so pripeti posamični atomi.
To podpoglavje je namenjeno predvsem zahtevnejšim dijakom, ki želijo poglobiti znanje o zgradbi molekul (se npr. pripravljajo na maturo ali tekmovanja iz kemije). Le nekatere sorazmerno preproste molekule z dvema centralnima atomoma bi morali poznati vsi gimnazijci.
Ugotavljanja struktur molekul z več centralnimi atomi se je smiselno lotiti, ko smo nabrali že dovolj izkušenj pri risanju zgradb molekul z enim centralnim atomom (glej gornji poglavji). Poleg tega je potrebno vedeti, kateri atomi so vezani med seboj:
V molekulah anorganskih oksokislin, na primer 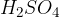 ,
, 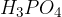 ,
, 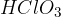 in podobnih, je vodik vezan na kisik. Na osrednji atom nekovine je torej vezanih toliko -OH skupin, kot je vodikovih atomov; drugi kisiki so vezani na osrednjo nekovino z dvojno vezjo.
in podobnih, je vodik vezan na kisik. Na osrednji atom nekovine je torej vezanih toliko -OH skupin, kot je vodikovih atomov; drugi kisiki so vezani na osrednjo nekovino z dvojno vezjo.
V molekulah organskih spojin moramo poznati dogovorjene zapise z racionalnimi formulami, predvsem za aldehide, karboksilne kisline in estre.
Pri drugih molekulah, ki so nam še nepoznane, lahko ugotovimo ustrezno strukturno formulo le v dveh primerih:
če imamo podatek, kateri atomi so povezani med seboj oziroma
nam uspe s poskušanjem ugotoviti ustrezno kombinacijo, pri kateri so zunanji elektroni v parih, atomi pa tvorijo ustrezno število vezi (to so znanja za stopnjo univerzitetnega študija).
Koristilo nam bo poznavanje možnih razporeditev vezi na najpomembnejših atomih (glej spodnjo tabelo). Tabela v nadaljevanju, tabela 5, prikazuje najpogostejše razporeditve vezi v molekulah.
Razporeditve vezi na atomih v tabeli 5 je sicer mogoče razložiti po postopkih, opisanih za molekule z enim centralnim atomom. S tabelo 5 pa si lahko pomagamo tako, da si skrajšamo postopek določanja strukture vezi za vsak centralni atom posebej. Tako lahko strukture z enim centralnim atomom dosti hitreje samo "sestavljamo" skupaj v celoto - v molekulo z več centralnimi atomi. Če jih imamo na razpolago, si lahko pri tem pomagamo tudi z različnimi fizičnimi modeli.
Strukturo molekul z več centralnimi atomi lahko ugotavljamo po naslednjem postopku:
V zapisu formule poiščemo atome, ki so v posameznih središčih, ter atome, ki so nanje vezani.
Za vsak posamezni centralni atom ugotovimo prostorsko razporeditev vezi okrog njega po postopku, opisanem v poglavjih "Zgradba enostavnih molekul" in "Molekule z dvojnimi ali trojnimi vezmi".
Posamezne centralne atome povežemo med seboj, na njih narišemo še vezane atome.
Za molekule organskih spojin navadno uporabljamo pravila za risanje strukturnih formul v ravnini, vendar se je dobro zavedati, da le-te ne prikažejo ustrezne prostorske razporeditve atomov (natančno v resnici težko narišemo).
Polarnost ali nepolarnost je osnovna značilnost molekule, ki določa sile med molekulami, kar posledično vpliva na fizikalne in kemijske lastnosti snovi.
Kadar kovalentno vez tvorita enaka atoma, le ta enako privlačita elektronski par. Porazdelitev naboja med atomoma je zato enakomerna.
V primerih, kadar kovalentno vez tvorita različna atoma, pa eden izmed atomov privlači elektronski par močneje kot drugi. Na atomu, ki elektronski par privlači močneje, je prebitek (presežek) negativnega naboja, na drugem pa primanjkljaj negativnega naboja (oziroma presežek pozitivnega naboja). Vez je zato polarna. Polarnost označujemo z malo grško črko delta: 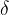 (glej spodnji primer).
(glej spodnji primer).
Polarnost tudi merimo. Merilo za polarnost je dipolni moment: bolj kot je polarna molekula (torej, bolj kot je elektronski par premaknjen v eno smer) večji dipolni moment ima molekula. Nepolarna molekula ima dipolni moment nič.
Elektronegativnost opredelimo kot sposobnost atoma, da privlači elektronski par. Večjo elektronegativnost ima element, ki je bolj desno v periodnem sistemu (če ne štejemo elementov VIII skupine oziroma žlahtnih plinov). Kadar sta elementa v isti skupini periodnega sistema, je bolj elektronegativen tisti, ki je višje. Element z največjo elektronegativnostjo je torej fluor.
Vrednosti za elektronegativnost in velikosti dipolnih momentov na srednješolski stopnji ne obravnavamo podrobneje. Določali bomo le, ali je neka molekula polarna ali nepolarna, za kar pa ni potrebno poznati vrednosti dipolnih momentov oziroma velikosti vektorjev. Videli bomo, da praviloma seštevamo vektorje enakih velikosti.
Kadar je v molekuli več polarnih vezi, se njihovi dipolni momenti vektorsko seštevajo.
Polarnost molekul je vektorska vsota polarnosti posameznih vezi.
Polarnost molekule ugotavljamo takole:
Določimo obliko molekule in narišemo ustrezno strukturno formulo.
Kovalentne vezi narišemo kot vektorje, ki so usmerjeni proti bolj elektronegativnemu atomu (to je tisti, ki je v periodnem sistemu bolj desno oziroma višje, če sta v isti skupini).
Prispevke posameznih vezi vektorsko seštejemo. Pri tem seveda lahko vektorje vzporedno premikamo. Pomagamo si s splošnim znanjem geometrije in poznavanjem geometrijskih likov in teles.
Poglejmo si dva primera.
Ker je seštevanje vektorjev v prostoru lahko težavno, če nimamo pri sebi ustreznega tridimenzionalnega modela, si velja zapomniti sledeče:
Vedno, kadar so na določen centralni atom tetraedrično vezani štirje enaki atomi, je vektorska vsota polarnosti posameznih vezi enaka nič. Takšna molekula je nepolarna.
Kadar pa (na srednješolskem nivoju) seštevamo vektorje / dipolne momente pri drugih možnih oblikah molekul, bi nam moralo zadoščati "osnovno" znanje geometrije, da ustrezno določimo polarnost.